Hvor kan elektroner være placeret når som helst?
Her er en sammenbrud:
* kvantemekanik: Elektroner styres af principperne for kvantemekanik, der dikterer, at deres opførsel i sagens natur er sandsynligt.
* orbitaler: Elektroner kredser ikke kernen i den traditionelle forstand af en planet, der cirkler en stjerne. I stedet besætter de regioner i rummet kaldet orbitaler , som er defineret af deres former og energiniveau.
* Sandsynlighedstæthed: Hver orbital er forbundet med en sandsynlighedstæthedsfunktion. Denne funktion fortæller os sandsynligheden for at finde et elektron på et givet tidspunkt i rummet inden for denne orbital.
* Elektronsky: Sandsynlighedsfordelingen af et elektron kan visualiseres som en elektronsky. Denne sky er tættere i regioner, hvor sandsynligheden for at finde elektronet er højere.
Sammenfattende er elektroner ikke begrænset til et specifikt punkt i rummet. Deres placering er beskrevet af en sandsynlighedsfordeling, hvilket betyder, at vi kun kan tale om sandsynligheden for at finde dem på et givet tidspunkt.
 Varme artikler
Varme artikler
-
 Lagring af data i DNA bringer naturen ind i det digitale universDen næste grænse for datalagring:DNA. Kredit:ymgerman/Shutterstock.com Menneskeheden producerer data i en ufattelig hastighed, til det punkt, at lagringsteknologier ikke kan følge med. Hvert femte
Lagring af data i DNA bringer naturen ind i det digitale universDen næste grænse for datalagring:DNA. Kredit:ymgerman/Shutterstock.com Menneskeheden producerer data i en ufattelig hastighed, til det punkt, at lagringsteknologier ikke kan følge med. Hvert femte -
 Lagring af lyn inde i torden:Forskere forvandler optiske data til læsbare lydbølgerDr. Birgit Stiller (til venstre) og Moritz Merklein i deres laboratorium i University of Sydney Nanoscience Hub. Kredit:Louise Connor/University of Sydney Forskere ved University of Sydney har dra
Lagring af lyn inde i torden:Forskere forvandler optiske data til læsbare lydbølgerDr. Birgit Stiller (til venstre) og Moritz Merklein i deres laboratorium i University of Sydney Nanoscience Hub. Kredit:Louise Connor/University of Sydney Forskere ved University of Sydney har dra -
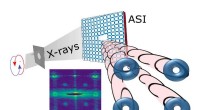 En ny metode til at generere og kontrollere orbitale vinkelmomentstrålerRøntgenfotoner spredt fra en kunstig spin-is (ASI), en mønstret række af nanoskala magneter, opnå orbital vinkelmomentum. Røntgenstrålerne kan tændes og slukkes med temperatur og magnetfelt. Indsat:Ek
En ny metode til at generere og kontrollere orbitale vinkelmomentstrålerRøntgenfotoner spredt fra en kunstig spin-is (ASI), en mønstret række af nanoskala magneter, opnå orbital vinkelmomentum. Røntgenstrålerne kan tændes og slukkes med temperatur og magnetfelt. Indsat:Ek -
 Metasurfaces til manipulation af terahertz -bølgerDe tilhørende THz -svar inkluderer fokusering, hologrammer, polarisationsmodulation, specielle bjælker og aktiv styring. Kredit:Xiaofei Zang, Bingshuang Yao, Lin Chen, Jingya Xie, Xuguang Guo, Alexei
Metasurfaces til manipulation af terahertz -bølgerDe tilhørende THz -svar inkluderer fokusering, hologrammer, polarisationsmodulation, specielle bjælker og aktiv styring. Kredit:Xiaofei Zang, Bingshuang Yao, Lin Chen, Jingya Xie, Xuguang Guo, Alexei
- Forskere finder, at algeforfader er nøglen til, hvordan dødelige patogener formerer sig
- Hajbiolog går sammen med luftfartsingeniør for at opdage adfærd fra oceaniske hvidspidser
- Satellit får natopfattelse af den store orkan Teddy
- Ny tropisk cyklonudsigtsmodel har potentiale til at redde liv i Stillehavet
- Hvad er Astmosphere of Mars?
- Styring af kvanteinteraktioner i et enkelt materiale


