Hvordan vidste Rutherford, hvor partikler gik efter at have været skudt på guldfolien?
1. Opsætningen: Rutherford skød alfa -partikler (positivt ladede heliumkerner) ved et tyndt ark guldfolie. Han placerede en fluorescerende skærm omkring folien.
2. Observationen: Han bemærkede, at de fleste af alfa -partiklerne passerede lige gennem folien, hvilket forårsagede lysglimt på skærmen direkte bag folien. Dette antydede, at atomer for det meste var tomt rum.
3. Det uventede: Imidlertid observerede han også nogle alfa -partikler, der spredte sig i store vinkler, selv hoppende tilbage mod kilden. Dette var helt uventet baseret på "blommepudding" -modellen af atomet, som antydede en diffus positiv ladning i hele atomet.
4. fortolkningen: Rutherford konkluderede, at den store vinkelspredning var forårsaget af en koncentreret positiv ladning inden for atomet, som han kaldte kernen. Han begrundede, at alfa -partiklerne blev afbøjet af den stærke elektriske frastødning mellem deres positive ladning og den positive ladning af kernen.
Så Rutherford så ikke direkte partiklernes stier, men han var i stand til at udlede stierne baseret på hvor de ramte den fluorescerende skærm. Afbøjningen af nogle partikler i store vinkler gav stærke bevis for eksistensen af kernen, en lille, tæt og positivt ladet kerne i atomet.
Sidste artikelHvor kan elektroner være placeret når som helst?
Næste artikelHvad er formlen for elektromagnetisk stråling?
 Varme artikler
Varme artikler
-
 Teoretisk model afslører, hvordan dråber vokser omkring små partikler på en overfladeVanddråber vokser omkring klynger af silicapartikler på en overflade. Kredit:Ref. 1 via CC-BY-4.0 © T. S. B. Quang et al. En matematisk model, der forudsiger, hvordan vand kondenserer omkring små
Teoretisk model afslører, hvordan dråber vokser omkring små partikler på en overfladeVanddråber vokser omkring klynger af silicapartikler på en overflade. Kredit:Ref. 1 via CC-BY-4.0 © T. S. B. Quang et al. En matematisk model, der forudsiger, hvordan vand kondenserer omkring små -
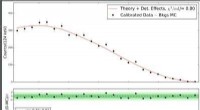 Et skridt fremad i løsningen af reaktor-neutrino-flux-problemetØverste panel:Sammenligning af den beregnede (røde linje) og målte (sorte prikker) spektrale former for henfald af Xe-137. Nederste panel:sorte prikker angiver afvigelsen af de beregnede punkter fra
Et skridt fremad i løsningen af reaktor-neutrino-flux-problemetØverste panel:Sammenligning af den beregnede (røde linje) og målte (sorte prikker) spektrale former for henfald af Xe-137. Nederste panel:sorte prikker angiver afvigelsen af de beregnede punkter fra -
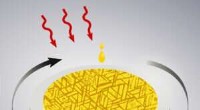 Forskere opdager en økonomisk måde at producere højtydende tynde film til elektronikSkematisk af spincoatingproces, der bruges til at producere epitaksiale film og nanokrystaller. Kredit:Meagan V. Kelso Forskere ved Missouri S&T har fundet en hidtil uset, økonomisk metode til at
Forskere opdager en økonomisk måde at producere højtydende tynde film til elektronikSkematisk af spincoatingproces, der bruges til at producere epitaksiale film og nanokrystaller. Kredit:Meagan V. Kelso Forskere ved Missouri S&T har fundet en hidtil uset, økonomisk metode til at -
 Forskere indser højeffektiv frekvenskonvertering på integreret fotonisk chipKredit:CC0 Public Domain Et team ledet af prof. GUO Guangcan og Prof. og opnåede krydsbåndsfrekvenskonvertering og forstærkning af konverteret signal ved at observere de kaskadede ikke-lineære opt
Forskere indser højeffektiv frekvenskonvertering på integreret fotonisk chipKredit:CC0 Public Domain Et team ledet af prof. GUO Guangcan og Prof. og opnåede krydsbåndsfrekvenskonvertering og forstærkning af konverteret signal ved at observere de kaskadede ikke-lineære opt
- Forskere finder den kølende effekt af aerosoler i cumulus- og MSC-skyer dobbelt så høj som antage…
- Egyptens arkæologer afdækker grave, der går tilbage til romertiden
- Den britiske fracking-industri ville have brug for streng kontrol for at minimere risikoen for spild
- Rapportering af forskningsresultater sat til boost under nyt system
- Hvad vi ved om medicin – orkanlignende storme i Middelhavet
- Jorden har nøglen til at opdage liv ud over vores solsystem


