Hvilke intermolekylære kræfter er PCL3 PCL3?
* molekylær geometri: PCL₃ har en trigonal pyramidal form på grund af det ensomme par elektroner på phosphoratomet. Denne asymmetriske form fører til et permanent dipolmoment.
* Polaritet: Elektronegativitetsforskellen mellem fosfor og klor skaber en polær binding, hvilket resulterer i et netto dipolmoment for hele molekylet.
Andre kræfter er til stede, men svagere:
* London Dispersion Forces: Mens svagere, er London -spredningskræfter altid til stede mellem molekyler på grund af midlertidige udsving i elektronfordelingen.
* Hydrogenbinding: PCL₃ udviser ikke hydrogenbinding, fordi det mangler et hydrogenatom bundet til et stærkt elektronegativt atom som ilt eller nitrogen.
Kortfattet: Mens London-spredningskræfter er til stede, er den dominerende intermolekylære kraft i PCL₃ dipol-dipolinteraktion på grund af dets permanente dipolmoment.
 Varme artikler
Varme artikler
-
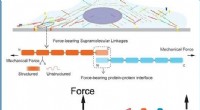 Måling af mekanisk stabilitet af kraftoverførings supramolekylære forbindelserIllustrationer af cellemekanotransduktionsforbindelser og enkeltmolekylemanipulationsassayet Toppanel:Skitse af en celle, der er fastgjort på en ekstracellulær matrix gennem dens supramolekylære mekan
Måling af mekanisk stabilitet af kraftoverførings supramolekylære forbindelserIllustrationer af cellemekanotransduktionsforbindelser og enkeltmolekylemanipulationsassayet Toppanel:Skitse af en celle, der er fastgjort på en ekstracellulær matrix gennem dens supramolekylære mekan -
 Heterostrukturer af grafen med sort fosfor, arsenlag muliggør nye infrarøde detektorerKredit:Daria Sokol/MIPT MIPT -forskere og deres kolleger fra Japan og USA har beregnet parametre for fotodetektorer bestående af lag af grafen og en kombination af sort fosfor og sort arsen. Disse
Heterostrukturer af grafen med sort fosfor, arsenlag muliggør nye infrarøde detektorerKredit:Daria Sokol/MIPT MIPT -forskere og deres kolleger fra Japan og USA har beregnet parametre for fotodetektorer bestående af lag af grafen og en kombination af sort fosfor og sort arsen. Disse -
 Nye Fermi-buer kunne give en ny vej til elektronikVenstre:Visuel progression af magnetbåndssplitningen, når temperaturen falder. Højre:Den øverste graf viser den kendte Zeeman- og Rashba-båndopdelingsadfærd. Nederst viser den nyligt observerede båndo
Nye Fermi-buer kunne give en ny vej til elektronikVenstre:Visuel progression af magnetbåndssplitningen, når temperaturen falder. Højre:Den øverste graf viser den kendte Zeeman- og Rashba-båndopdelingsadfærd. Nederst viser den nyligt observerede båndo -
 Kan voksne overvinde matematikangst?Andrea Gordon får hjælp til sin matematikangst fra matematiker og dramatiker John Mighton, grundlægger af Jump matematikprogrammet. Han siger, at alle kan opdage matematikkens glæder. Richard Lautens/
Kan voksne overvinde matematikangst?Andrea Gordon får hjælp til sin matematikangst fra matematiker og dramatiker John Mighton, grundlægger af Jump matematikprogrammet. Han siger, at alle kan opdage matematikkens glæder. Richard Lautens/
- Er ultraviolette stråler en partikel af radioaktivt forfald?
- Er din kaffe ikke varm eller kold? At observere, hvordan hjernen behandler negerede adjektiver
- Hvis temperaturen er 30 grader F, hvorfor får vi nogle gange sne
- Global undersøgelse afslører sundhedsvirkninger af luftbårne sporstoffer
- Astronomistuderende søger efter kæmpe ringe med billeder fra 1890
- Flydende kernefibre:En dataflod løber gennem dem


