Hvorfor er S Orbital Fyld før P Orbital?
* Energiniveau: Elektroner optager specifikke energiniveauer inden for et atom. Lavere energiniveau er tættere på kernen og er mere stabile.
* Sublers: Inden for hvert energiniveau er underniveauer, betegnet med bogstaver:S, P, D og F. Hver underniveau har et lidt andet energiniveau.
* S vs. P: S -underniveauet er lavere i energi end P -underniveauet inden for det samme vigtigste energiniveau. Dette betyder, at et elektron vil fylde S -orbitalen, før det fylder p orbitalen.
Eksempel:
* I det andet energiniveau (n =2) er 2'erne orbital lavere i energi end 2p -orbitaler. Derfor udfylder 2'erne orbital før 2p -orbitaler.
visuel repræsentation:
Du kan visualisere dette ved hjælp af et diagram kaldet et orbital energi diagram . Diagrammet viser de relative energiniveauer for orbitaler. S orbitaler er altid lavere end P -orbitaler inden for det samme energiniveau.
Nøglepunkter:
* aufbau -princip: Dette princip siger, at elektroner fylder orbitaler i rækkefølge af stigende energi.
* Hunds regel: Elektroner vil individuelt besætte orbitaler inden for et subderi, før de parrer sig.
* Pauli Ekskluderingsprincip: Ingen to elektroner i et atom kan have det samme sæt med fire kvantetal (inklusive spin).
Ved at følge disse principper kan du forudsige elektronkonfigurationen af ethvert atom.
 Varme artikler
Varme artikler
-
 På vej til det optiske atomurPTB-videnskabsmand Johannes Thielking med laseropsætningen til målinger af thorium-229 nukleare egenskaber. Kredit:PTB Kernen af thorium-229 besidder en egenskab, der er unik blandt alle kendte
På vej til det optiske atomurPTB-videnskabsmand Johannes Thielking med laseropsætningen til målinger af thorium-229 nukleare egenskaber. Kredit:PTB Kernen af thorium-229 besidder en egenskab, der er unik blandt alle kendte -
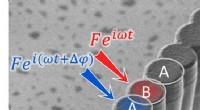 Danningen af gap-solitoner i et 1D-dissipativt topologisk gitterScanningelektronmikroskopibillede, der viser en kæde af halvlederhulrum. Afstanden mellem hulrummene er moduleret, hvilket giver anledning til to forskellige værdier af koblingen J og J mellem tilstød
Danningen af gap-solitoner i et 1D-dissipativt topologisk gitterScanningelektronmikroskopibillede, der viser en kæde af halvlederhulrum. Afstanden mellem hulrummene er moduleret, hvilket giver anledning til to forskellige værdier af koblingen J og J mellem tilstød -
 Fysikere demonstrerer afblandingsadfærd af roterende partiklerKredit:Christian Scholz, HHU Fysikere fra Friedrich-Alexander-Universität Erlangen-Nürnberg og Heinrich-Heine Universität Düsseldorf har påvist, at afblanding sker i systemer, der består af makros
Fysikere demonstrerer afblandingsadfærd af roterende partiklerKredit:Christian Scholz, HHU Fysikere fra Friedrich-Alexander-Universität Erlangen-Nürnberg og Heinrich-Heine Universität Düsseldorf har påvist, at afblanding sker i systemer, der består af makros -
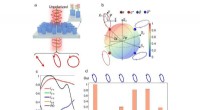 Vilkårlig polariseringskonvertering dikroisme metasoverflader til fulde Poincaré -kuglepolarisator…en, Skematisk af den foreslåede alt-i-en-polarisator, der kan fungere på en vilkårlig position på Poincaré-kuglen ved design baseret på en dielektrisk metasoverflade, der består af dimeriserede nanopi
Vilkårlig polariseringskonvertering dikroisme metasoverflader til fulde Poincaré -kuglepolarisator…en, Skematisk af den foreslåede alt-i-en-polarisator, der kan fungere på en vilkårlig position på Poincaré-kuglen ved design baseret på en dielektrisk metasoverflade, der består af dimeriserede nanopi
- Sveriges Ericsson lancerer AI-laboratorium i Canada
- Tar solcelledrevne lasere til nye højder med fire-spejlpumpning
- Platform til mobilnetværk vil bringe tjenester op til hastigheder på 100 Gbps
- Rutiner, øvelse og mental genhør mindsker nogle – men ikke alle – risici for væbnet selvforsvar
- Hvordan man laver krystaller ved brug af Borax
- Undersøgelse finder, at stigende ozon er en skjult trussel mod majs


