Hvorfor løber PH -skalaen normalt fra 0 til 14 er det muligt for omfanget ud over og 14, så hvordan?
PH -skalaen er baseret på koncentrationen af brintioner (H+) i en opløsning.
* ph 0: Repræsenterer en meget høj koncentration af H+ -ioner, hvilket indikerer en stærk sur opløsning.
* pH 7: Repræsenterer en neutral opløsning, hvor koncentrationen af H+ -ioner er lig med koncentrationen af hydroxidioner (OH-).
* ph 14: Repræsenterer en meget lav koncentration af H+ -ioner, hvilket indikerer en stærkt alkalisk (grundlæggende) opløsning.
ud over 0 og 14:
* opløsninger med pH under 0: Disse er ekstremt sure og har en endnu højere koncentration af H+ -ioner end en opløsning med pH 0. Dette er muligt med stærkt koncentrerede syrer.
* opløsninger med pH over 14: Disse er ekstremt alkaliske og har en meget lav koncentration af H+ -ioner, endnu lavere end en pH 14 -opløsning. Dette er muligt med stærkt koncentrerede baser.
Eksempler:
* koncentreret svovlsyre (H2SO4): Kan have en pH mindre end 0.
* koncentreret natriumhydroxid (NaOH): Kan have en pH -værdi på mere end 14.
Hvorfor misforståelsen?
0-14-serien er en praktisk grænse for de fleste hverdagens løsninger. De mest almindelige syrer og baser falder inden for dette interval. I ekstreme tilfælde, som meget koncentrerede opløsninger, kan pH imidlertid gå ud over denne grænse.
Det er vigtigt at huske, at PH -skalaen er logaritmisk, hvilket betyder, at hver hele antal ændringer repræsenterer en ti gange ændring i koncentrationen af H+ ioner. Dette gør det muligt at udtrykke meget høje og meget lave koncentrationer inden for en håndterbar skala.
Sidste artikelHvad er eksplaneringen af Newtons tredje bevægelse?
Næste artikelHvorfor er S Orbital Fyld før P Orbital?
 Varme artikler
Varme artikler
-
 Ny elektronisk køleteknologi til at muliggøre miniaturisering af kvantecomputereKredit:VTT Technical Research Center of Finland VTT -forskere har med succes demonstreret en ny elektronisk køleteknologi, der kan muliggøre store spring i udviklingen af kvantecomputere. Nuvære
Ny elektronisk køleteknologi til at muliggøre miniaturisering af kvantecomputereKredit:VTT Technical Research Center of Finland VTT -forskere har med succes demonstreret en ny elektronisk køleteknologi, der kan muliggøre store spring i udviklingen af kvantecomputere. Nuvære -
 Optisk fiberbilleddannelsesmetode fremmer undersøgelser af Alzheimers sygdomMultimode fiberoutput (nederst) sammenlignet med den traditionelle rasterscanningsbilleddannelse (øverst), der bruges i mikroendoskopi. Kredit:Benjamin Lochocki En optisk fiber så tynd som en hårst
Optisk fiberbilleddannelsesmetode fremmer undersøgelser af Alzheimers sygdomMultimode fiberoutput (nederst) sammenlignet med den traditionelle rasterscanningsbilleddannelse (øverst), der bruges i mikroendoskopi. Kredit:Benjamin Lochocki En optisk fiber så tynd som en hårst -
 Forskere realiserer real-time GW-BSE undersøgelser af spin-dal exciton dynamikKredit:CC0 Public Domain Prof. Zhao Jins forskerhold fra University of Science and Technology of China (USTC) har gjort vigtige fremskridt i udviklingen af spin-valley exciton-dynamik. Forskning
Forskere realiserer real-time GW-BSE undersøgelser af spin-dal exciton dynamikKredit:CC0 Public Domain Prof. Zhao Jins forskerhold fra University of Science and Technology of China (USTC) har gjort vigtige fremskridt i udviklingen af spin-valley exciton-dynamik. Forskning -
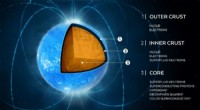 Nye simuleringsmetoder til at visualisere kvanteeffekter i superfluid fermionerSkematisk struktur af en neutronstjerne. Kredit:Watts, A et al., Rev. Mod. Phys. 88, 021001 Hvad der præcist sker inde i neutronstjerner - sidste fase af en kæmpestjerne - er genstand for spekulat
Nye simuleringsmetoder til at visualisere kvanteeffekter i superfluid fermionerSkematisk struktur af en neutronstjerne. Kredit:Watts, A et al., Rev. Mod. Phys. 88, 021001 Hvad der præcist sker inde i neutronstjerner - sidste fase af en kæmpestjerne - er genstand for spekulat


