Hvad er radius for et atom i picometers?
* atomradier varierer: Størrelsen på et atom afhænger af flere faktorer, herunder:
* atomnummer (antal protoner): Når du bevæger dig over det periodiske tabel, øges antallet af protoner i kernen, hvilket tiltrækker elektroner stærkere, hvilket fører til en mindre atomradius.
* Antal elektronskaller: Atomer med flere elektronskaller er større.
* type obligation: Radius kan være lidt anderledes afhængigt af om atomet er i en metallisk, ionisk eller kovalent binding.
* Ingen nøjagtig grænse: Elektronskyen, der omgiver et atom, har ikke en skarp, defineret kant. Atomradier måles typisk som afstanden mellem centre for to tilstødende atomer i et molekyle eller krystal.
Her er hvad du kan sige:
* Generelle tendenser: Du kan finde generelle tendenser i atomradier baseret på periodisk tabelposition. For eksempel har atomer i gruppe 1 (alkalimetaller) en tendens til at være større end atomer i gruppe 17 (halogener).
* specifikke værdier: Du kan finde den omtrentlige atomradier af specifikke elementer i forskellige referencebøger eller online ressourcer. Disse værdier gives ofte som kovalente radier, der repræsenterer halvdelen af afstanden mellem kernerne i to identiske atomer bundet sammen.
Eksempel:
Den kovalente radius for et carbonatom er omkring 77 picometre. Dette betyder, at afstanden mellem kernerne i to carbonatomer, der er bundet sammen, er ca. 154 picometre.
For at finde radius for et specifikt atom, skal du slå sin specifikke værdi op i en referencekilde.
 Varme artikler
Varme artikler
-
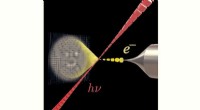 Ny teknik muliggør formning af elektronstrålerNylige eksperimenter ved universitetet i Wien viser, at lys (rødt) kan bruges til vilkårlig at forme elektronstråler (gul), hvilket åbner nye muligheder inden for elektronmikroskopi og metrologi. Kred
Ny teknik muliggør formning af elektronstrålerNylige eksperimenter ved universitetet i Wien viser, at lys (rødt) kan bruges til vilkårlig at forme elektronstråler (gul), hvilket åbner nye muligheder inden for elektronmikroskopi og metrologi. Kred -
 Hvorfor skyrmioner kan have meget til fælles med glas og højtemperatur-superledereØverst:Billeder baseret på simuleringer viser, hvordan tre faser af stof, inklusive skyrmioner - små hvirvler skabt af elektronernes spin - kan dannes i visse magnetiske materialer. De er striber af e
Hvorfor skyrmioner kan have meget til fælles med glas og højtemperatur-superledereØverst:Billeder baseret på simuleringer viser, hvordan tre faser af stof, inklusive skyrmioner - små hvirvler skabt af elektronernes spin - kan dannes i visse magnetiske materialer. De er striber af e -
 Sådan fungerer fraktalerDette delvise billede af Mandelbrot -sættet, muligvis verdens mest berømte fraktal, viser trin fire i en zoomsekvens:Det centrale endepunkt for søhestens hale er også et Misiurewicz -punkt. Wolfgang B
Sådan fungerer fraktalerDette delvise billede af Mandelbrot -sættet, muligvis verdens mest berømte fraktal, viser trin fire i en zoomsekvens:Det centrale endepunkt for søhestens hale er også et Misiurewicz -punkt. Wolfgang B -
 Køleteknik hjælper forskere med at målrette en vigtig komponent til en ny kolliderArgonne højenergifysiker Wei Gai og ingeniør Scott Doran arbejder på et nyudviklet positronmål, der kan hjælpe med at give en nøglekomponent til den foreslåede International Linear Collider. Kredit:We
Køleteknik hjælper forskere med at målrette en vigtig komponent til en ny kolliderArgonne højenergifysiker Wei Gai og ingeniør Scott Doran arbejder på et nyudviklet positronmål, der kan hjælpe med at give en nøglekomponent til den foreslåede International Linear Collider. Kredit:We
- Supercomputermodel afslører, hvordan klæbende tape laver grafen
- Forskere bruger magnetiske systemer til kunstigt at reproducere hjernens indlærings- og glemmefunkt…
- Hvad står SBDT for elektrisk?
- Frankrig spærrer ikke, men kan begrænse Huawei i 5G-netværket
- Hvad er elementerne indeholdt i ammoniak?
- Simpel proces ekstraherer værdifuldt magnesiumsalt fra havvand


