Er atommasserne af nogle elementer faktisk fraktioneret?
* isotoper: De fleste elementer findes i naturen som en blanding af forskellige isotoper. Isotoper er atomer med det samme element, der har det samme antal protoner (definerer elementet), men forskellige antal neutroner. Denne forskel i neutroner resulterer i forskellige masser for hver isotop.
* Vægtet gennemsnit: Den atommasse, der er anført på den periodiske tabel, er et vægtet gennemsnit af masserne af alle naturligt forekommende isotoper af dette element. Vægtningen er baseret på den relative overflod af hver isotop.
Eksempel:Carbon
* Carbon-12 (6 protoner, 6 neutroner) har en masse på 12 atommasseenheder (AMU).
* Carbon-13 (6 protoner, 7 neutroner) har en masse på 13 amu.
* Carbon-14 (6 protoner, 8 neutroner) har en masse på 14 amu (meget sjælden).
Carbon-12 er den mest rigelige isotop, der udgør ca. 98,9% af det naturlige kulstof. Carbon-13 er ca. 1,1% rigelig. Den gennemsnitlige atommasse af kulstof beregnes som:
(0,989 x 12 amu) + (0,011 x 13 amu) ≈ 12,01 amu
Nøglepunkt: Atommassen af et element er et vægtet gennemsnit, ikke massen af et enkelt atom. Da isotoperne har forskellige masser og forekomster, vises det resulterende gennemsnit ofte som en brøkdel.
Sidste artikelHvorfor udfylder en s orbital før en p orbital?
Næste artikelHvordan var Albert Einstein og Michael Faraday lignende?
 Varme artikler
Varme artikler
-
 Formskiftende spejl åbner udsigt til fremtidenFig. 1. Nyt limfrit deformerbart spejl. Kredit:JTEC Et team af forskere fra JTEC Corporation og Osaka University udviklede et bimorft deformerbart spejl, der giver mulighed for præcis formændring
Formskiftende spejl åbner udsigt til fremtidenFig. 1. Nyt limfrit deformerbart spejl. Kredit:JTEC Et team af forskere fra JTEC Corporation og Osaka University udviklede et bimorft deformerbart spejl, der giver mulighed for præcis formændring -
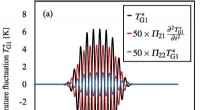 Teoretisk model, der beskriver bevægelsen af ultralydsbølger i nærværelse af flere boblerTidsudvikling af temperaturudsvinget TG1 ∗ (a) ved lydkilden (grænsetilstand) og (b) ved fokus i fig. 3 (a), hvor gassen inde i boblen er argon. De sorte, røde og blå kurver repræsenterer bølgeformern
Teoretisk model, der beskriver bevægelsen af ultralydsbølger i nærværelse af flere boblerTidsudvikling af temperaturudsvinget TG1 ∗ (a) ved lydkilden (grænsetilstand) og (b) ved fokus i fig. 3 (a), hvor gassen inde i boblen er argon. De sorte, røde og blå kurver repræsenterer bølgeformern -
 Separate eksperimenter viser ingen tegn på krænkelse af Lorentz invarianceKredit:C. Carreau/ESA, via Fysik (Phys.org) - To hold forskere, der arbejder uafhængigt af hinanden, har udført eksperimenter designet til at teste Lorentz invarians; begge rapporterer ingen ove
Separate eksperimenter viser ingen tegn på krænkelse af Lorentz invarianceKredit:C. Carreau/ESA, via Fysik (Phys.org) - To hold forskere, der arbejder uafhængigt af hinanden, har udført eksperimenter designet til at teste Lorentz invarians; begge rapporterer ingen ove -
 Sociale bakterier bygger beskyttelsesrum ved hjælp af fingeraftryks fysikNår maden er knap, medlemmer af en art af skovlevende bakterier går sammen om at bygge strukturer kaldet frugtlegemer for at overleve, indtil mad bliver mere tilgængelig. Princeton -forskere har ident
Sociale bakterier bygger beskyttelsesrum ved hjælp af fingeraftryks fysikNår maden er knap, medlemmer af en art af skovlevende bakterier går sammen om at bygge strukturer kaldet frugtlegemer for at overleve, indtil mad bliver mere tilgængelig. Princeton -forskere har ident
- Hvem fandt på ideen om Pangaea?
- Hvad er fosfor tekstur?
- Hvordan Madrid-forhandlingerne kom til kort med klimaambitioner
- Hvorfor blev Carbon valgt, da basen Amu Thay kunne have brugt noget andet element?
- Livets byggesten kan være dannet i interstellare skyer
- Elastiske dyser kunne skabe mere stabile væskestråler


