Hvorfor udfylder en s orbital før en p orbital?
* Energiniveau: S orbitaler er på et lavere energiniveau end P -orbitaler inden for den samme elektronskal. Dette betyder, at en elektron i en S -orbital i gennemsnit er tættere på kernen og oplever en stærkere attraktion.
* form: S orbitaler er sfæriske, mens p orbitaler er håndvægtformede. Denne forskel i form påvirker den rumlige fordeling af elektroner og påvirker deres energiniveau.
* Elektronelektronafvisning: S orbital er mindre og mere kompakt end P orbital. Dette betyder, at elektronerne i en s orbital oplevelse mindre frastødning fra hinanden, hvilket gør S -orbitalen til et mere energisk gunstigt sted for elektroner.
Sammendrag:
Kombinationen af lavere energiniveau, mindre størrelse og mindre elektronelektronafvisning i S-orbitaler sammenlignet med P-orbitaler fører til påfyldning af S-orbitaler før P-orbitaler. Dette princip er grundlæggende for at forstå den elektroniske konfiguration af atomer og opførsel af kemiske elementer.
 Varme artikler
Varme artikler
-
 NA64 jagter den mystiske mørke fotonEn oversigt over NA64 eksperimentelle set-up på CERN. NA64 jagter mørke fotoner, hypotetiske partikler i mørkt stof. Kredit:Maximilien Brice/CERN En af de største gåder i fysikken er, at femogfirs
NA64 jagter den mystiske mørke fotonEn oversigt over NA64 eksperimentelle set-up på CERN. NA64 jagter mørke fotoner, hypotetiske partikler i mørkt stof. Kredit:Maximilien Brice/CERN En af de største gåder i fysikken er, at femogfirs -
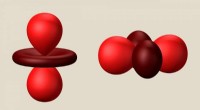 Forskere bryder forbindelsen mellem et kvantematerialespin og orbitale tilstandeDisse ballon-og-skive-former repræsenterer en elektronorbital - en fuzzy elektronsky omkring et atoms kerne - i to forskellige orienteringer. Forskere håber på en dag at bruge variationer i orbitalern
Forskere bryder forbindelsen mellem et kvantematerialespin og orbitale tilstandeDisse ballon-og-skive-former repræsenterer en elektronorbital - en fuzzy elektronsky omkring et atoms kerne - i to forskellige orienteringer. Forskere håber på en dag at bruge variationer i orbitalern -
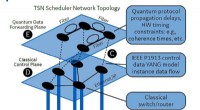 For at udvikle kvante netværk, industriens unikke behov skal overvejes og kan give en løsningKontrolmekanisme for foreslået kvantennetværk. Kredit:Stephen F. Bush Der er blevet foreslået store kvantenetværk, men indtil videre, de findes ikke. Nogle komponenter i, hvad der ville udgøre såd
For at udvikle kvante netværk, industriens unikke behov skal overvejes og kan give en løsningKontrolmekanisme for foreslået kvantennetværk. Kredit:Stephen F. Bush Der er blevet foreslået store kvantenetværk, men indtil videre, de findes ikke. Nogle komponenter i, hvad der ville udgøre såd -
 2021:Et år spurgte fysikere:Hvad ligger der hinsides standardmodellen?Eksperimenter med Large Hadron Collider i Europa, ligesom ATLAS-kalorimeteret, der ses her, giver mere nøjagtige målinger af fundamentale partikler. Kredit:Maximilien Brice, CC BY Hvis du beder en
2021:Et år spurgte fysikere:Hvad ligger der hinsides standardmodellen?Eksperimenter med Large Hadron Collider i Europa, ligesom ATLAS-kalorimeteret, der ses her, giver mere nøjagtige målinger af fundamentale partikler. Kredit:Maximilien Brice, CC BY Hvis du beder en
- For at vise den faraoniske arv paraderer Egypten kongelige mumier
- Metode til at lave ilt fra vand uden tyngdekraft giver håb om langdistance-rumrejser
- Hjalp et vulkanudbrud i Alaska en ende på den romerske republik?
- Gå på månen – under vandet
- Sådan fungerer Krispy Kremes
- Hvad er et værktøj med perforeret overflade, der bruges til at fjerne urenheder fra væsker?


