Hvorfor kan partiklerne i en flydende overvinde nogle kræfter attraktion?
* kinetisk energi: Partikler i enhver tilstand af stof (fast, flydende, gas) bevæger sig konstant. Denne bevægelse kaldes kinetisk energi . Jo højere temperatur, jo hurtigere bevæger partiklerne sig og jo større er deres kinetiske energi.
* Intermolekylære kræfter: Kræfterne til tiltrækning mellem partikler i en væske kaldes intermolekylære kræfter . Disse kræfter er svagere end de kræfter, der holder atomer sammen i et molekyle (intramolekylære kræfter).
* balance: I en væske har partiklerne nok kinetisk energi til at overvinde nogle af de intermolekylære kræfter, så de kan glide forbi hinanden. De er ikke så fritflydende som en gas, men de er ikke stift fastgjort som et solidt.
her er en simpel analogi: Forestil dig en gruppe mennesker, der holder hænder. Hvis de alle står stille, holder grebet af deres hænder (intermolekylære kræfter) dem sammen. Hvis de begynder at bevæge sig (kinetisk energi), kan de muligvis løsne deres greb lidt, så de kan glide forbi hinanden.
Sådan spiller dette ud i en væske:
* Fluiditet: Partiklernes evne til at glide forbi hinanden giver væsker deres karakteristiske fluiditet. De kan flyde og tage formen på deres beholder.
* Kompressibilitet: Mens væsker er mere komprimerbare end faste stoffer, er de mindre komprimerbare end gasser. Dette skyldes, at partiklerne stadig er relativt tæt sammen, og der er mindre plads til dem at blive presset ind.
Vigtig note: Styrken af de intermolekylære kræfter og mængden af kinetisk energi, der er til stede, bestemmer et stofs stof. I et fast stof er de intermolekylære kræfter stærke nok til at holde partiklerne i en fast, stiv struktur. I en gas er den kinetiske energi høj nok til at overvinde alle de intermolekylære kræfter, hvilket gør det muligt for partiklerne at bevæge sig frit og udvide for at fylde deres beholder.
Sidste artikelHvor meget g kraft ville 10 gange jorden være tyngdekraft være?
Næste artikelEn front er en, der adskiller to luftmasser?
 Varme artikler
Varme artikler
-
 Optrævling af fysikken bag at smide stegte risKinematik af at kaste stegte ris. (a) Wokkastning på Chin Chin-restauranten i Atlanta, GA, USA. Fotokredit:Candler Hobbs. (b–e) Billedsekvens, der viser wok-kastningsprocessen. De farvede punkter vise
Optrævling af fysikken bag at smide stegte risKinematik af at kaste stegte ris. (a) Wokkastning på Chin Chin-restauranten i Atlanta, GA, USA. Fotokredit:Candler Hobbs. (b–e) Billedsekvens, der viser wok-kastningsprocessen. De farvede punkter vise -
 Boblernes fysik kan forklare sprogmønstreKredit:University of Portsmouth Sprogmønstre kunne forudsiges ved simple fysiske love, en ny undersøgelse har fundet. Dr. James Burridge fra University of Portsmouth har offentliggjort en teori v
Boblernes fysik kan forklare sprogmønstreKredit:University of Portsmouth Sprogmønstre kunne forudsiges ved simple fysiske love, en ny undersøgelse har fundet. Dr. James Burridge fra University of Portsmouth har offentliggjort en teori v -
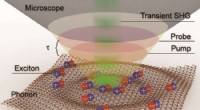 Billedlydbevægelser af atomenheder med et optisk mikroskopSkematisk billede af måleskemaet. Kredit:Daegu Gyeongbuk Institute of Science and Technology (DGIST) Et internationalt forskerteam, ledet af Dr. Hyunmin Kim fra Companion Diagnostics and Medical T
Billedlydbevægelser af atomenheder med et optisk mikroskopSkematisk billede af måleskemaet. Kredit:Daegu Gyeongbuk Institute of Science and Technology (DGIST) Et internationalt forskerteam, ledet af Dr. Hyunmin Kim fra Companion Diagnostics and Medical T -
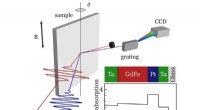 Efter ultrahurtig magnetiseringsdynamik i dybdenSkematisk illustration af den eksperimentelle spektroskopi-opsætning, der blev brugt til de tidsopløste T-MOKE-målinger. Prøven exciteres optisk af femtosekunds infrarøde laserimpulser (2 µm bølgelæng
Efter ultrahurtig magnetiseringsdynamik i dybdenSkematisk illustration af den eksperimentelle spektroskopi-opsætning, der blev brugt til de tidsopløste T-MOKE-målinger. Prøven exciteres optisk af femtosekunds infrarøde laserimpulser (2 µm bølgelæng
- SKAK røntgenbilleder viser, hvordan man dyrker krystaller af
- Undersøgelse:At involvere offentligheden i vandpolitikker er nøglen til vellykkede kommunale vands…
- Giver USA internettet væk?
- Hvidhed er kernen i racisme i Storbritannien, så hvorfor fremstilles det som et sort problem?
- Lucky MESSENGER-data ophæver en langvarig idé om Venus-atmosfære
- Forskere tilbyder et kig på livet, da den caribiske vulkan brød ud


