Hvis antallet af elektroner er 44, hvor mange kan der gå ind i hver bane?
Forståelse af elektronkreds (skaller og underskaller)
* Elektronskaller: Dette er energiniveau omkring kernen i et atom. De er nummereret 1, 2, 3 osv., Med højere antal, der indikerer højere energiniveau.
* underskaller: Inden for hver skal er underskaller, mærket S, P, D og F. Hver underskal kan indeholde et specifikt antal elektroner:
* s underskal:2 elektroner
* P Subshell:6 elektroner
* D Subshell:10 elektroner
* f Underskal:14 elektroner
udfyldning af orbitaler
Elektroner udfylder orbitaler i henhold til specifikke regler, kaldet Aufbau -princippet og Hunds regel. For at bestemme antallet af elektroner i hver orbital, har du brug for elementets atomnummer, der fortæller dig det samlede antal elektroner.
Lad os sige, at elementet har 44 elektroner. Sådan kan vi begynde at udfylde dets orbitaler:
1. shell 1: Det har kun et 's' underskal, der indeholder 2 elektroner.
2. Shell 2: Det har 'og' P 'underskaller, der holder 2 + 6 =8 elektroner.
3. Shell 3: Det har 's', 'p' og 'd' subshells, der holder 2 + 6 + 10 =18 elektroner.
4. Shell 4: Vi er op til 18 elektroner i de første tre skaller og efterlader 26 elektroner. Shell 4 har 'S', 'P', 'D' og 'F' underskaller. Lad os fylde dem:
* 'S':2 elektroner
* 'P':6 elektroner
* 'D':10 elektroner (vi har nu brugt 18 elektroner i skal 4)
* 'F':Da vi har 26 elektroner tilbage i shell 4, bruger vi kun 8 elektroner i underskalet 'F', hvilket efterlader 18 elektroner til den næste skal.
vigtige noter
* Det nøjagtige antal elektroner i hver orbital afhænger af det specifikke element.
* Aufbau -princippet og Hunds regel bestemmer rækkefølgen af udfyldning af orbitaler, som kan være komplekse for elementer med mange elektroner.
For nøjagtigt at bestemme antallet af elektroner i hver orbital, skal du kende elementets atomnummer.
 Varme artikler
Varme artikler
-
 Voksende kvanteprikker i et almindeligt arrangementMoiré-mønsteret:Her blev en grøn skærm fotograferet med et digitalkamera. Både skærmen og halvlederchippen i digitalkameraet har et almindeligt pixelgitter. Superpositionen af de to gitter og minima
Voksende kvanteprikker i et almindeligt arrangementMoiré-mønsteret:Her blev en grøn skærm fotograferet med et digitalkamera. Både skærmen og halvlederchippen i digitalkameraet har et almindeligt pixelgitter. Superpositionen af de to gitter og minima -
 Team opnåede kontrol på højt niveau af spin qubit levetid baseret på silicium kvanteprikkerKredit:CC0 Public Domain Ved at justere retningen af det eksterne magnetfelt i forhold til siliciumwaferens krystallografiske akse, en forbedring af spin-levetiden (afslapningstid) med over to s
Team opnåede kontrol på højt niveau af spin qubit levetid baseret på silicium kvanteprikkerKredit:CC0 Public Domain Ved at justere retningen af det eksterne magnetfelt i forhold til siliciumwaferens krystallografiske akse, en forbedring af spin-levetiden (afslapningstid) med over to s -
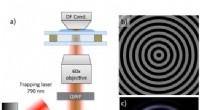 Reaktivt optisk stof:Lysinduceret bevægelseDiagram over den eksperimentelle optiske fælde beskrevet i teksten. Opsætningen indeholder en spatial lysmodulator (SLM), mørk feltkondensator (DF kond.), dichroic-mirror (DM) og quarter wave plate (Q
Reaktivt optisk stof:Lysinduceret bevægelseDiagram over den eksperimentelle optiske fælde beskrevet i teksten. Opsætningen indeholder en spatial lysmodulator (SLM), mørk feltkondensator (DF kond.), dichroic-mirror (DM) og quarter wave plate (Q -
 Computerteoretikere viser vejen til at verificere, at kvante slår klassiskNærbillede af en Intel computing wafer. Kredit:Steve Jurvetson Mens flere forskergrupper rundt om i verden kapløb om at bygge en skalerbar kvantecomputer, Der er stadig spørgsmål om, hvordan opnåe
Computerteoretikere viser vejen til at verificere, at kvante slår klassiskNærbillede af en Intel computing wafer. Kredit:Steve Jurvetson Mens flere forskergrupper rundt om i verden kapløb om at bygge en skalerbar kvantecomputer, Der er stadig spørgsmål om, hvordan opnåe
- Ørkenboende bakterier giver spor til beboelighed på mars
- Hvad syre gør ved mælk?
- Påvisning af kulilte i kroppen kan føre til hurtig sygdomsdiagnostik
- Soundscape-undersøgelse viser, hvordan underjordisk akustik kan forstærke jordens sundhed
- Forståelse af 'underforbrugskerne':Hvordan en ny trend udfordrer forbrugerkulturen
- Høje geotermiske temperaturer fundet dybt under de sydlige alper


