Hvad er forholdet mellem molmasse og London -spredningskræfter?
* Større molekyler har flere elektroner: Molmasse er direkte proportional med antallet af atomer i et molekyle. Større molekyler har flere elektroner, hvilket betyder, at der er en større chance for, at midlertidige dipoler dannes.
* Midlertidige dipoler: Bevægelsen af elektroner inden for et molekyle kan skabe midlertidige, øjeblikkelige dipoler. Disse dipoler er kortvarige, men de kan inducere dipoler i de nærliggende molekyler, hvilket fører til attraktioner.
* øget overfladeareal: Større molekyler har et større overfladeareal, hvilket øger potentialet for interaktion mellem midlertidige dipoler. Dette fører til stærkere London -spredningskræfter.
Kortfattet:
* Større molekyler (højere molær masse) =flere elektroner =mere midlertidige dipoler =stærkere London -spredningskræfter.
Eksempel:
Overvej halogenerne (F2, CL2, BR2, I2). Når du bevæger dig ned ad gruppen, øges den molære masse. Som et resultat øges styrken af London -spredningskræfterne, hvilket fører til højere smelte- og kogepunkter. Denne tendens kan observeres i de stigende smelte- og kogepunkter på halogenerne, når du går fra fluor til jod.
Vigtig note: Mens London -spredningskræfter er til stede i alle molekyler, er de primær intermolekylær kraft For ikke -polære molekyler. Dette skyldes, at ikke -polære molekyler mangler permanente dipoler, så London -spredningskræfter er den eneste attraktive kraft mellem dem.
Sidste artikelHvilken videnskabelig metode følger eksperimentet?
Næste artikelHvilken mængde bruges til at måle kraft?
 Varme artikler
Varme artikler
-
 Bringer opdagelser frem i lyset:røntgenvidenskab i ArgonneArgonne-fysiker Mary Upton justerer en højopløselig monokromator som forberedelse til et eksperiment ved Advanced Photon Source. Kredit:Argonne National Laboratory I mere end 25 år, den avancerede
Bringer opdagelser frem i lyset:røntgenvidenskab i ArgonneArgonne-fysiker Mary Upton justerer en højopløselig monokromator som forberedelse til et eksperiment ved Advanced Photon Source. Kredit:Argonne National Laboratory I mere end 25 år, den avancerede -
 Baner vejen for omdefinering af temperaturenhedenPTB-forsker Christof Gaiser med kernen i det dielektrisk-konstante gastermometer. De forskellige sølvfarvede trykbeholdere har specielle kondensatorer, som er fyldt med helium for at udføre den måling
Baner vejen for omdefinering af temperaturenhedenPTB-forsker Christof Gaiser med kernen i det dielektrisk-konstante gastermometer. De forskellige sølvfarvede trykbeholdere har specielle kondensatorer, som er fyldt med helium for at udføre den måling -
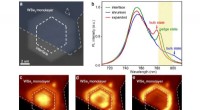 Forskning i den fotoniske krystaltopologiske tilstand ud over den optiske diffraktionsgrænseKarakterisering af Z2 topologiske kanttilstand og dens mørke linje. Kredit:Compuscript Ltd En ny publikation fra Opto-Electronic Advances overvejer forskning i fotoniske krystaltopologiske tilstand
Forskning i den fotoniske krystaltopologiske tilstand ud over den optiske diffraktionsgrænseKarakterisering af Z2 topologiske kanttilstand og dens mørke linje. Kredit:Compuscript Ltd En ny publikation fra Opto-Electronic Advances overvejer forskning i fotoniske krystaltopologiske tilstand -
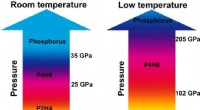 Afdækning af den superledende phosphin:P2H4 og P4H6Højtryksfasediagrammerne for PH3 ved stuetemperatur og lav temperatur. Kredit:© Science China Press High-Tc superledere er blevet et varmt emne i fysik, siden superledende kviksølv først blev rapp
Afdækning af den superledende phosphin:P2H4 og P4H6Højtryksfasediagrammerne for PH3 ved stuetemperatur og lav temperatur. Kredit:© Science China Press High-Tc superledere er blevet et varmt emne i fysik, siden superledende kviksølv først blev rapp


