Hvorfor smelter salt og sukker is?
* Frysningspunktdepression: Vand fryser ved 32 ° F (0 ° C). Når du tilsætter salt eller sukker, forstyrrer det vandmolekylernes evne til at danne den krystalstruktur, der er nødvendig til frysning. Dette sænker effektivt den temperatur, hvormed vand fryser.
* salt: Salt opløses i vand og danner ioner (ladede partikler). Disse ioner kommer i vejen for vandmolekylerne, hvilket gør det sværere for dem at binde og fryse.
* sukker: Sukker opløses også i vand, men i stedet for ioner danner det en "sukkeropløsning." Denne opløsning har et lavere frysepunkt end rent vand, fordi sukkermolekylerne forstyrrer vandmolekylets evne til at danne iskrystaller.
Hvorfor er dette nyttigt?
* de-icing: Salt bruges ofte til at smelte is på veje og fortove, fordi det sænker vandets frysepunkt under den typiske omgivelsestemperatur, hvilket gør det lettere for isen at smelte.
* Fødevarekonservering: Sukker bruges i syltetøj og gelé for at forhindre frysning. Den høje sukkerkoncentration sænker blandingen af blandingen.
Vigtig note: Mens både salt og sukker sænker vandets frysepunkt, er salt meget mere effektivt end sukker på grund af tilstedeværelsen af ioner.
 Varme artikler
Varme artikler
-
 Lavpris solcelledrevet vandfilter fjerner bly, andre forurenende stofferI en undersøgelse foretaget ved Princeton University, forskere placerede gelen i søvand, hvor den absorberede rent vand, efterlader forurenende stoffer. Forskerne placerede derefter gelen i solen, hvo
Lavpris solcelledrevet vandfilter fjerner bly, andre forurenende stofferI en undersøgelse foretaget ved Princeton University, forskere placerede gelen i søvand, hvor den absorberede rent vand, efterlader forurenende stoffer. Forskerne placerede derefter gelen i solen, hvo -
 Den schweiziske hærkniv af røgskærmeEn ny type røggranat, der kan skjule sensorer i det synlige og infrarøde område, brænder under en test. Kredit:US Army At udløse røgbomber er mere end god fornøjelse den fjerde juli. Militæret bru
Den schweiziske hærkniv af røgskærmeEn ny type røggranat, der kan skjule sensorer i det synlige og infrarøde område, brænder under en test. Kredit:US Army At udløse røgbomber er mere end god fornøjelse den fjerde juli. Militæret bru -
 Absorberende aerogel viser nogle musklerEn simpel kemisk proces udviklet på Rice University skaber lette og meget absorberende aerogeler baseret på kovalente organiske rammer til miljøsanering eller som membraner til batterier og andre appl
Absorberende aerogel viser nogle musklerEn simpel kemisk proces udviklet på Rice University skaber lette og meget absorberende aerogeler baseret på kovalente organiske rammer til miljøsanering eller som membraner til batterier og andre appl -
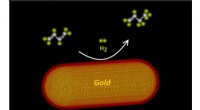 Tværfagligt samarbejde fører til katalysatorer, der er op til 50 gange mere effektiveKemiske reaktioner forekommer på overfladen af bimetalliske nanopartikler. Forskere fandt ud af, at arrangering af de to metaller i et kerneskalledesign gør disse katalysatorer op til 50 gange mere
Tværfagligt samarbejde fører til katalysatorer, der er op til 50 gange mere effektiveKemiske reaktioner forekommer på overfladen af bimetalliske nanopartikler. Forskere fandt ud af, at arrangering af de to metaller i et kerneskalledesign gør disse katalysatorer op til 50 gange mere
- Oldtidens kunst er inspirerende moderne elektronik
- Sådan foretages matricer på en TI-89
- Hvad får højere temperaturer til at gøre?
- Nyt materiale kan forbedre hurtig og præcis DNA -sekventering
- Den kinesiske domstol forbyder salg af iPhone i patentkonflikter:Qualcomm
- Kinesisk sonde lander på månen for at indsamle måneprøver (opdatering)


