Hvordan er sagen klasificeret?
1. Klassificering efter fysisk tilstand:
* fast: Har en bestemt form og volumen. Molekyler er tæt pakket og vibrerer i faste positioner.
* væske: Har et bestemt volumen, men har formen på sin beholder. Molekyler er tæt pakket, men kan bevæge sig rundt.
* gas: Har ingen bestemt form eller volumen. Molekyler er langt fra hinanden og bevæger sig frit.
* plasma: En overophedet gas, hvor elektroner strippes fra atomer, hvilket skaber en blanding af ioner og frie elektroner. Det er den mest almindelige tilstand af stof i universet.
2. Klassificering ved kemisk sammensætning:
* elementer: Rene stoffer, der ikke kan opdeles i enklere stoffer på kemiske midler. Hvert element består af kun en type atom. Eksempler:ilt, kulstof, guld.
* Forbindelser: Stoffer dannet af den kemiske kombination af to eller flere forskellige elementer i et fast forhold. Eksempler:Vand (H 2 O), kuldioxid (co 2 ), bordsalt (NaCl).
* Blandinger: Kombinationer af to eller flere stoffer, der ikke er kemisk bundet. Komponenterne i en blanding kan adskilles med fysiske midler.
* homogene blandinger: Har ensartet sammensætning og egenskaber overalt. Eksempler:saltvand, luft.
* heterogene blandinger: Har ikke-ensartet sammensætning og egenskaber. Forskellige dele af blandingen kan let identificeres. Eksempler:sand og vand, olie og vand.
Yderligere klassifikationer:
* rene stoffer: Elementer og forbindelser betragtes som rene stoffer, fordi de har en fast sammensætning.
* uren stoffer: Blandinger betragtes som urene stoffer, fordi de har variabel sammensætning.
Dette klassificeringssystem bruges til at organisere og forstå det store udvalg af stof i universet.
Sidste artikelHvilke skridt følger du i et eksperiment?
Næste artikelHvilken væskekraft modsætter sig løft?
 Varme artikler
Varme artikler
-
 Forskere fremmer teknik til udvikling af nye lysstråler fra synkrotronstrålingKredit:CC0 Public Domain Struktureret lys, skabt ved at generere og påføre lys på en overflade, er vigtig i sådanne applikationer som 3-D scannere, dobbeltfotografering og mikroskopisk teknologi.
Forskere fremmer teknik til udvikling af nye lysstråler fra synkrotronstrålingKredit:CC0 Public Domain Struktureret lys, skabt ved at generere og påføre lys på en overflade, er vigtig i sådanne applikationer som 3-D scannere, dobbeltfotografering og mikroskopisk teknologi. -
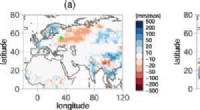 Fingeraftryk af ekstremt vejr afsløret ved ny statistisk tilgang2010 russisk hedebølge. (a) Sammensat af nedbørsanomalifelter konstrueret som i fig. 3. (b) Middel observerede anomalifelter i august 2010 (CRU TS4 datasæt). Kredit:DOI:10.1103/PhysRevLett.127.058701
Fingeraftryk af ekstremt vejr afsløret ved ny statistisk tilgang2010 russisk hedebølge. (a) Sammensat af nedbørsanomalifelter konstrueret som i fig. 3. (b) Middel observerede anomalifelter i august 2010 (CRU TS4 datasæt). Kredit:DOI:10.1103/PhysRevLett.127.058701 -
 Forskere genererer afstembare to partikler af lysEn ny teknik ser to forskellige lyspartikler komme ind i en chip, og to identiske tvillingpartikler af lys forlader den. Billedet kombinerer kunstnerisk rejsen mellem to partikler af lys langs yderkan
Forskere genererer afstembare to partikler af lysEn ny teknik ser to forskellige lyspartikler komme ind i en chip, og to identiske tvillingpartikler af lys forlader den. Billedet kombinerer kunstnerisk rejsen mellem to partikler af lys langs yderkan -
 Observationen af Kardar-Parisi-Zhang hydrodynamik i et kvantematerialeEn række uafhængige spin -kæder, der leder varme og centrifugerer langs deres længde. Kvasipartikler vist i rødt interagerer og kolliderer med hinanden og danner en mærkelig væske med KPZ -universalit
Observationen af Kardar-Parisi-Zhang hydrodynamik i et kvantematerialeEn række uafhængige spin -kæder, der leder varme og centrifugerer langs deres længde. Kvasipartikler vist i rødt interagerer og kolliderer med hinanden og danner en mærkelig væske med KPZ -universalit
- Hvor mange elektroner er den ydre skal af klor?
- Liste over lande i Frigid Zone
- Aqua satellit ser orkanen Michael styrke sig
- Verdens første video af en rum-tid-krystal
- Generering og anvendelse af høj-Q-resonansen i alle dielektriske metaoverflader
- Efter krisen:Sådan undgår du (nogle af) vores vildledende overbevisninger


