Hvad er den gennemsnitlige hastighed for brintmolekyler?
* kinetisk molekylær teori: Den gennemsnitlige hastighed for gasmolekyler er direkte relateret til deres temperatur. Højere temperaturer betyder hurtigere bevægelige molekyler.
* Root Mean Square Speed: Den mest almindelige måde at udtrykke gennemsnitlig hastighed for gasser på er rodmidlet kvadrathastighed (VRMS) . Det beregnes ved hjælp af denne ligning:
VRMS =√ (3RT/M)
Hvor:
* R er den ideelle gaskonstant (8.314 j/mol · k)
* T er temperaturen i Kelvin
* M er den molære masse af gassen (for H2, den er 2,016 g/mol)
Eksempel:
Lad os sige, at temperaturen er 298 K (stuetemperatur). Tilslutning i ligningen:
VRMS =√ (3 * 8.314 J/mol · K * 298 K/0,002016 kg/mol) ≈ 1929 m/s
Konklusion:
Den gennemsnitlige hastighed for brintmolekyler ved stuetemperatur er ca. 1929 m/s. Men denne hastighed ændres markant, hvis temperaturen ændres.
 Varme artikler
Varme artikler
-
 Unikt terahertz -mikroskop kan fjernbetjenesNiels van Hoof. Kredit:Eindhoven University of Technology Med en bølgelængde på omkring en halv millimeter, terahertz -stråling fylder hullet mellem synligt lys og radiobølger. Denne stråling egne
Unikt terahertz -mikroskop kan fjernbetjenesNiels van Hoof. Kredit:Eindhoven University of Technology Med en bølgelængde på omkring en halv millimeter, terahertz -stråling fylder hullet mellem synligt lys og radiobølger. Denne stråling egne -
 Elektroner venter på deres tur:Ny model forklarer 3D kvantematerialeElektroner i et topologisk kvantemetal, der venter på at blive aktiveret af et magnetfelt. Når de begynder at bevæge sig, de følger en spiralformet helix opad - i modsætning til det tidligere foreslåe
Elektroner venter på deres tur:Ny model forklarer 3D kvantematerialeElektroner i et topologisk kvantemetal, der venter på at blive aktiveret af et magnetfelt. Når de begynder at bevæge sig, de følger en spiralformet helix opad - i modsætning til det tidligere foreslåe -
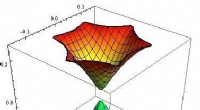 Ny metode til at analysere spredningskurven for topologiske isolatorerSpektrum af Hamiltonian (1) i nul eksterne felter. Kredit:Lobachevsky University Topologiske isolatorer er nye materialer, der er blevet undersøgt af mange forskningsgrupper rundt om i verden i me
Ny metode til at analysere spredningskurven for topologiske isolatorerSpektrum af Hamiltonian (1) i nul eksterne felter. Kredit:Lobachevsky University Topologiske isolatorer er nye materialer, der er blevet undersøgt af mange forskningsgrupper rundt om i verden i me -
 Forståelse for aktiemarkedsafkast:Hvilke modeller passer bedst?Kredit:CC0 Public Domain Forståelse af aktiemarkedsafkast afhænger af forståelsen af deres volatilitet. To enkle, men konkurrerende modeller har været dominerende i årtier:Heston -modellen, indf
Forståelse for aktiemarkedsafkast:Hvilke modeller passer bedst?Kredit:CC0 Public Domain Forståelse af aktiemarkedsafkast afhænger af forståelsen af deres volatilitet. To enkle, men konkurrerende modeller har været dominerende i årtier:Heston -modellen, indf
- Er den korrekte ligning for reaktion under et molekyle af propangas reagerer med fem molekyler ilt t…
- Hvordan bruges friktion til klatring?
- Hvilket indeholder et tungt atom, der ofte bruges i nukleare fissionsreaktioner til at producere ter…
- Spisereservationsappen OpenTable rykker i levering
- Afblanding ved hjælp af lasere for at lave nye krystaller
- Forskere undersøger 3-D-printede legeringer med høj entropi


