Hvorfor er der en stigning i størrelsen på atomer, når du går ned ad periodisk tabel -kasse inerte gasser?
1. Stigende antal elektronskaller:
* Når du bevæger dig ned ad den periodiske tabel, får hvert på hinanden følgende element en ekstra elektronskal. Disse skaller er placeret længere væk fra kernen.
* Tænk på det som at tilføje flere lag til en løg - det ydre lag er længere væk fra midten.
2. Afskærmningseffekt:
* De indre elektronskaller (tættere på kernen) skjuler de ydre elektroner fra den fulde positive ladning af kernen.
* Denne afskærmningseffekt svækker tiltrækningen mellem kernen og de yderste elektroner, hvilket gør dem lettere at fjerne og få atomradiusen til at stige.
3. Svag nuklear attraktion:
* Når antallet af elektronskaller øges, spredes kernenes positive ladning over et større volumen. Dette reducerer styrken af tiltrækningen mellem kernen og de yderste elektroner.
inerte gasser (ædelgasser)
* Inerlige gasser har en fuld ydre skal af elektroner, hvilket gør dem usædvanligt stabile og ureaktive.
* Stigningen i atomstørrelse er stadig til stede i inerte gasser, fordi de samme faktorer (flere elektronskaller, afskærmning) spiller.
Eksempel:
* Helium (HE) er den mindste inerte gas med kun en elektronskal.
* Radon (RN) er den største inerte gas med syv elektronskaller.
Fortæl mig, hvis du har andre spørgsmål!
 Varme artikler
Varme artikler
-
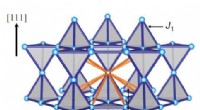 Ny indsigt i magnetiske kvanteeffekter i faste stofferModellen refererer til en kubisk krystalstruktur (pyrochlorgitter). Ikke kun var magnetiske interaktioner mellem de nærmeste naboer inkluderet, men også med de nærmeste nærmeste naboer (se tegning). K
Ny indsigt i magnetiske kvanteeffekter i faste stofferModellen refererer til en kubisk krystalstruktur (pyrochlorgitter). Ikke kun var magnetiske interaktioner mellem de nærmeste naboer inkluderet, men også med de nærmeste nærmeste naboer (se tegning). K -
 Konstruerede metasurfaces erstatter tape i specialiseret mikroskopEt uorden-konstrueret metamateriale (det beige rektangel) spreder indkommende lys som en del af et fremskridt inden for optik, der bruger lysspredning til at give billeder med en høj opløsning og et b
Konstruerede metasurfaces erstatter tape i specialiseret mikroskopEt uorden-konstrueret metamateriale (det beige rektangel) spreder indkommende lys som en del af et fremskridt inden for optik, der bruger lysspredning til at give billeder med en høj opløsning og et b -
 Hvordan forudsagde Benjamin Gompertz vores dødsfald?A Dance of Death af Michael Wolgemut (1434–1519), en tysk maler og grafiker. Historisk billedarkiv/Corbis/Getty Images At have en arv er rart, men hvad nu hvis den opdagelse, der bærer dit navn for e
Hvordan forudsagde Benjamin Gompertz vores dødsfald?A Dance of Death af Michael Wolgemut (1434–1519), en tysk maler og grafiker. Historisk billedarkiv/Corbis/Getty Images At have en arv er rart, men hvad nu hvis den opdagelse, der bærer dit navn for e -
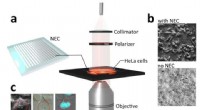 Nanofotonik forbedret dækglas til fasebilleddannelse i biologia Nanophotonics enhanced coverslip (NEC) tilføjer fasebilleddannelsesevne til et normalt mikroskopdækglas, derved krympe voluminøse fase-billeddannelsesmetoder ned til størrelsen af en chip. Det min
Nanofotonik forbedret dækglas til fasebilleddannelse i biologia Nanophotonics enhanced coverslip (NEC) tilføjer fasebilleddannelsesevne til et normalt mikroskopdækglas, derved krympe voluminøse fase-billeddannelsesmetoder ned til størrelsen af en chip. Det min
- Sollys nedbryder polystyren hurtigere end forventet
- Strukturerede ledelsesprotokoller hjælper virksomheder med at trives
- ExoMars finder nye gassignaturer i Mars-atmosfæren
- Hvem kan afkøle sin krop hurtigt? Tukan
- Schweiz vil placere væddemål på spillelovgivningen i folkeafstemningen med høje indsatser
- Hvad er de 3 systemer, der producerer ATP?


