Hvordan fungerer brint som en ikke -metal?
1. Elektronisk konfiguration og reaktivitet:
* Hydrogen har kun en proton og en elektron, hvilket gør det ligner halogenerne (gruppe 17) med hensyn til dens elektroniske konfiguration.
* Det får let et elektron til at danne en negativ ion (H-), svarende til halogener, som er ikke-metaller.
* Hydrogen danner kovalente bindinger med andre ikke -metaller, danner molekyler som H₂O (vand) og NH₃ (ammoniak), et typisk egenskab for ikke -metaller.
2. Fysiske egenskaber:
* Hydrogen findes som en diatomisk gas (H₂) ved stuetemperatur, en karakteristisk delt med de fleste ikke -metaller.
* Det er en dårlig leder af varme og elektricitet, i modsætning til metaller.
* Hydrogen er gennemsigtigt og farveløst og understøtter yderligere dens ikke -metale klassificering.
3. Kemiske egenskaber:
* Hydrogen er meget reaktiv og kombinerer let med ilt for at danne vand, et kendetegn for ikke -metaller.
* Den danner let syrer med halogener, en anden indikation af dens ikke -metalliske karakter.
Hydrogen udviser imidlertid også nogle metalliske egenskaber:
* Under ekstremt tryk kan det opføre sig som et metal, der udviser metallisk binding og høj elektrisk ledningsevne. Dette skyldes dets evne til at danne en metallisk brintfase.
* Det kan miste et elektron til at danne en positiv ion (H+), svarende til metaller.
Konklusion:
Mens brint udviser både metalliske og ikke -metalliske egenskaber, stemmer dens samlede opførsel mere tæt sammen med ikke -metaller. Dens elektroniske konfiguration, reaktivitet og fysiske egenskaber ligner mere dem for ikke -metaller, hvilket gør det generelt klassificeret som en ikke -metal. Imidlertid fremhæver dens evne til at udvise metalliske egenskaber under ekstreme forhold sin unikke position i den periodiske tabel.
 Varme artikler
Varme artikler
-
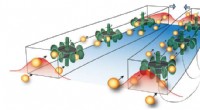 Metode til væsentligt at øge den optiske kraftForstærket optisk kraft. Når lys strømmer ind i bølgelederen lavet af metamateriale, fotonerne (gule) bliver narret til at bevæge sig til den ene side. Her visualiseres handlingen af rotorerne (grøn
Metode til væsentligt at øge den optiske kraftForstærket optisk kraft. Når lys strømmer ind i bølgelederen lavet af metamateriale, fotonerne (gule) bliver narret til at bevæge sig til den ene side. Her visualiseres handlingen af rotorerne (grøn -
 Brug af terahertz-stråling med lang bølgelængde til at producere video med en høj billedhastighe…Terahertz -stråling kan bruges til mange former for billeddannelse, f.eks. i lufthavne eller ved test af ikke -destruktive materialer. En ny teknik bruger den til højhastighedsvideo. Kredit:Sequestim/
Brug af terahertz-stråling med lang bølgelængde til at producere video med en høj billedhastighe…Terahertz -stråling kan bruges til mange former for billeddannelse, f.eks. i lufthavne eller ved test af ikke -destruktive materialer. En ny teknik bruger den til højhastighedsvideo. Kredit:Sequestim/ -
 PPPL-forskere leverer ny højopløsningsdiagnostik til national laserfacilitetDe tre spektrometerkanaler inde i instrumentet. Kredit:Elle Starkman Forskere fra US Department of Energys (DOE) Princeton Plasma Physics Laboratory (PPPL) har bygget og leveret et højopløselig rø
PPPL-forskere leverer ny højopløsningsdiagnostik til national laserfacilitetDe tre spektrometerkanaler inde i instrumentet. Kredit:Elle Starkman Forskere fra US Department of Energys (DOE) Princeton Plasma Physics Laboratory (PPPL) har bygget og leveret et højopløselig rø -
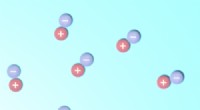 Mekanisme opdeler elektronspin i magnetisk materialeEn skematisk afbildning af virtuelle elektron-positron-par, der optræder tilfældigt nær en elektron (nederst til venstre). Kredit:RJHall/Wikipedia Med det rigtige materiale i den rigtige vinkel har
Mekanisme opdeler elektronspin i magnetisk materialeEn skematisk afbildning af virtuelle elektron-positron-par, der optræder tilfældigt nær en elektron (nederst til venstre). Kredit:RJHall/Wikipedia Med det rigtige materiale i den rigtige vinkel har
- Sæbebobler til at forudsige cyklonens intensitet?
- Sådan lærer du matematik i Primary School
- Hvilken form for energi bevæger sig spontant fra varme genstande til kolde genstande?
- Hvilke grundstoffer udgør natriumhydroxid?
- Den tropiske storm Faxai får et navn, og NASA får et infrarødt billede
- Efterhånden som flere udviklingslande afviser eksport af plastaffald, rige nationer søger løsning…


