Hvor meget hurtigere bevæger helium sig end Argon?
* Temperaturafhængighed: Gasmolekylernes hastighed er direkte relateret til deres temperatur. Jo varmere gassen er, jo hurtigere bevæger molekylerne sig. For at sammenligne helium og argon er vi nødt til at kende temperaturen.
* Gennemsnitlig hastighed vs. individuel hastighed: Gasmolekyler bevæger sig med en række hastigheder. Vi taler typisk om molekylernes * gennemsnitlige * hastighed. Selv ved den samme temperatur vil heliummolekyler have en højere gennemsnitshastighed end argonmolekyler.
* rod-middel-kvadrathastighed: En almindelig måde at måle den gennemsnitlige hastighed for gasmolekyler er "rod-middel-kvadrathastighed" (RMS-hastighed). Det beregnes ved hjælp af følgende formel:
`` `
V_RMS =√ (3RT/M)
`` `
hvor:
* V_RMS er rod-middel-kvadrathastigheden
* R er den ideelle gaskonstant
* T er temperaturen i Kelvin
* M er den molære masse af gassen
hvordan helium er hurtigere:
* lavere molmasse: Helium har en meget lavere molmasse end argon (4 g/mol vs. 40 g/mol). Dette betyder, at heliummolekyler ved den samme temperatur bevæger sig hurtigere.
* Eksempel: Lad os sige, at vi har helium og argon ved 298 K (25 ° C). Tilslutning af disse værdier til formlen ovenfor, vi får:
* V_RMS (HE) =√ (3 * 8.314 J/mol · K * 298 K/0,004 kg/mol) ≈ 1352 m/s
* V_RMS (AR) =√ (3 * 8.314 J/mol · K * 298 K/0,04 kg/mol) ≈ 431 m/s
Dette viser, at heliummolekyler bevæger sig ca. 3 gange hurtigere end argonmolekyler ved stuetemperatur.
Konklusion: Helium bevæger sig hurtigere end argon ved den samme temperatur, fordi den har en meget lavere molær masse.
 Varme artikler
Varme artikler
-
 At tæmme multiverset – Stephen Hawkings sidste teori om big bangStephen Hawking. Kredit:Andre Pattenden Professor Stephen Hawkings sidste teori om universets oprindelse, som han arbejdede på i samarbejde med professor Thomas Hertog fra KU Leuven, er blevet off
At tæmme multiverset – Stephen Hawkings sidste teori om big bangStephen Hawking. Kredit:Andre Pattenden Professor Stephen Hawkings sidste teori om universets oprindelse, som han arbejdede på i samarbejde med professor Thomas Hertog fra KU Leuven, er blevet off -
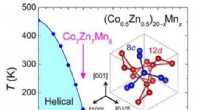 Uordnet skyrmionfase stabiliseret af magnetisk frustration i en chiral magnetNulfelt magnetisk fasediagram med temperatur (T) og Mn-sammensætning (x), der forbinder Co10Zn10 og β-Mn ifølge (Co0.5Zn0.5)20−xMnx. En spinglasfase viser sig at eksistere ved lave temperaturer og ove
Uordnet skyrmionfase stabiliseret af magnetisk frustration i en chiral magnetNulfelt magnetisk fasediagram med temperatur (T) og Mn-sammensætning (x), der forbinder Co10Zn10 og β-Mn ifølge (Co0.5Zn0.5)20−xMnx. En spinglasfase viser sig at eksistere ved lave temperaturer og ove -
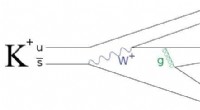 Ultra-sjælden kaon henfald kan føre til tegn på ny fysikEt eksempel på feynman -diagram over et kaonforfald. En kaon, lavet af en op og mærkelig antikvitet, henfalder både svagt og stærkt i tre pioner, med mellemliggende trin, der involverer en W boson og
Ultra-sjælden kaon henfald kan føre til tegn på ny fysikEt eksempel på feynman -diagram over et kaonforfald. En kaon, lavet af en op og mærkelig antikvitet, henfalder både svagt og stærkt i tre pioner, med mellemliggende trin, der involverer en W boson og -
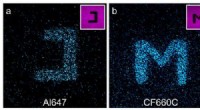 Hvordan photoblueing forstyrrer mikroskopiKonfokale fluorescensbilleder af glasoverflader belagt med cyaninfarvestofferne Alexa Fluor 647 (a) og CF660C (b) og med carborhodaminfarvestof ATTO647N (c) efter lysexcitation ved 568 nanometer (nm).
Hvordan photoblueing forstyrrer mikroskopiKonfokale fluorescensbilleder af glasoverflader belagt med cyaninfarvestofferne Alexa Fluor 647 (a) og CF660C (b) og med carborhodaminfarvestof ATTO647N (c) efter lysexcitation ved 568 nanometer (nm).
- Strukturen, der huser cellerne genetiske oplysninger.?
- Team bruger magnetiserede neuroner til at behandle symptomer på Parkinsons sygdom
- Hvordan forårsager en ændring i hastighedsbølge til retning?
- Hvordan er tyngdekraften involveret i dannelsen af stjerner?
- Er varmelys og elektricitetsformer for energi?
- Giver følelse af tumult under havet for at lokalisere rystelser nær dybe havfejl


