Hvordan kan man bevise, at partikler af materie kontinuerligt bevæger sig?
1. Direkte bevis:
* brownisk bevægelse: Dette er den tilfældige bevægelse af partikler suspenderet i en væske (som pollenkorn i vand). Observeret i 1827 af Robert Brown forklares dette fænomen ved den konstante bombardement af de suspenderede partikler af de bevægelige fluidmolekyler.
* Elektronmikroskopi: Selvom de ikke direkte observerer bevægelse, kan elektronmikroskoper forestille sig arrangementet af atomer og molekyler i materialer, hvilket giver os et øjebliksbillede af deres organisation.
2. Indirekte bevis:
* diffusion: Spredningen af et stof i hele et medium (som en dråbe blæk i vand) skyldes partiklernes tilfældige bevægelse, hvilket får dem til at kollidere og sprede sig.
* Temperatur og varme: Temperaturen er et mål for den gennemsnitlige kinetiske energi af partikler i et stof. Jo hurtigere de bevæger sig, jo højere er temperaturen. Varmeoverførsel er strømmen af energi på grund af bevægelsen af disse partikler.
* tryk: Det tryk, der udøves af en gas, skyldes kollisionerne af dens partikler med containerens vægge. Jo mere energiske partiklerne (dvs. jo højere er temperaturen), jo mere pres udøver de.
* Fordampning og sublimering: Disse processer forekommer, fordi partikler med nok kinetisk energi overvinder de attraktive kræfter, der holder dem sammen i en væske eller fast og flugt ind i gasfasen.
3. Teoretisk bevis:
* kinetisk teori om stof: Denne teori siger, at al sag er lavet af partikler, der er i konstant tilfældig bevægelse. Det forklarer mange fysiske fænomener, herunder egenskaber ved gasser, væsker og faste stoffer.
* Statistisk mekanik: Dette fysikfelt giver en matematisk ramme til at beskrive opførslen af store samlinger af partikler baseret på deres gennemsnitlige egenskaber.
Konklusion: Selvom vi ikke direkte kan se individuelle partikler bevæge sig, understøtter det overvældende bevis fra eksperimenter, observationer og teoretiske modeller stærkt begrebet kontinuerlig bevægelse af partikler i stof.
 Varme artikler
Varme artikler
-
 Maskinlæring finder nye metamaterialedesigns til energihøstEn illustration af et dielektrisk metamateriale med infrarødt lys, der skinner på det. Kredit:Willie Padilla, Duke University Elektriske ingeniører ved Duke University har udnyttet kraften i maski
Maskinlæring finder nye metamaterialedesigns til energihøstEn illustration af et dielektrisk metamateriale med infrarødt lys, der skinner på det. Kredit:Willie Padilla, Duke University Elektriske ingeniører ved Duke University har udnyttet kraften i maski -
 Nyt billeddannelsessystem afslører solpanelfejl selv i stærkt sollysForskerne brugte en InGaAs-detektor med en meget høj billedhastighed til at optage en sekvens af billeder af solpaneler, da en moduleret elektrisk strøm blev påført. Den meget hurtige billedhastighed,
Nyt billeddannelsessystem afslører solpanelfejl selv i stærkt sollysForskerne brugte en InGaAs-detektor med en meget høj billedhastighed til at optage en sekvens af billeder af solpaneler, da en moduleret elektrisk strøm blev påført. Den meget hurtige billedhastighed, -
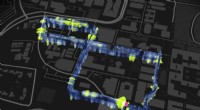 Forskere bygger en milliard sensorer jordskælvsobservatorium med optiske fibreKort viser placeringen af en 3-mile, 8-sløjfe af optiske fibre installeret under Stanford-campus som en del af det fiberoptiske seismiske observatorium. Kredit:Stamen Design og Victoria and Albert M
Forskere bygger en milliard sensorer jordskælvsobservatorium med optiske fibreKort viser placeringen af en 3-mile, 8-sløjfe af optiske fibre installeret under Stanford-campus som en del af det fiberoptiske seismiske observatorium. Kredit:Stamen Design og Victoria and Albert M -
 Nyt mikroskop fanger detaljerede 3D-film af celler dybt inde i levende systemerInde i rygmarven i et zebrafiskembryo, nye neuroner lyser op i forskellige farver, lade forskere følge udviklingen af nervekredsløb. Kredit:T. Liu et al./Science 2018 Vores vindue ind i mobilver
Nyt mikroskop fanger detaljerede 3D-film af celler dybt inde i levende systemerInde i rygmarven i et zebrafiskembryo, nye neuroner lyser op i forskellige farver, lade forskere følge udviklingen af nervekredsløb. Kredit:T. Liu et al./Science 2018 Vores vindue ind i mobilver
- Hvad kaldes studiet af et lille blad?
- Hvilken by ligger ved 34 grader N Latitude 118 W -længdegrad?
- Hvad kaldes det, når materialer med lav masse smeltes sammen for at danne stoffer højere masse?
- Opnå distribueret retningslytting med fiberakustisk sansning
- At undervurdere skjulte fordele ved floder underminerer økonomier og bæredygtig udvikling
- SwRI-byggede CYGNSS-satellitter indsamler hidtil usete orkandata


