Hvad er en forbindelse mellem Joule og Kelvin?
* joules (j) Mål Energi . Dette er kapaciteten til at udføre arbejde eller producere varme.
* kelvins (k) Mål temperatur . Dette er et mål for den gennemsnitlige kinetiske energi for partiklerne i et system.
Imidlertid er der forbindelser gennem specifikke koncepter:
* Varmekapacitet: Forholdet mellem varmeenergi (målt i joule) og temperaturændring (målt i kelvins) er beskrevet af varmekapacitet . Den specifikke varmekapacitet af et stof fortæller dig, hvor meget energi (i joules) der kræves for at hæve temperaturen på et gram af dette stof med en Kelvin.
* termodynamiske processer: I termodynamik kan ændringer i intern energi (målt i Joules) relateres til ændringer i temperatur (målt i Kelvins) gennem ligninger som følgende:
* ΔU =ncvΔT (Hvor ΔU er ændring i intern energi, er N antallet af mol, CV er den molære varmekapacitet ved konstant volumen, og ΔT er ændringen i temperatur).
* Statistisk mekanik: På et mikroskopisk niveau er temperaturen relateret til den gennemsnitlige kinetiske energi af partikler, og den samlede energi i et system er en sum af de kinetiske og potentielle energier i dets partikler. Denne forbindelse er beskrevet af statistisk mekanik.
Kortfattet: Joules og Kelvins er forskellige enheder, der måler forskellige ting. De er imidlertid forbundet i forskellige sammenhænge relateret til energi og temperatur, især i termodynamik og statistisk mekanik.
 Varme artikler
Varme artikler
-
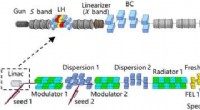 Ny tilgang til generering af sammenhængende og ultrakorte bløde røntgenimpulserSkematisk af EEHC eksperimentet. Den øverste strålelinje viser linacen, som består af en fotokatode rf pistol, et laservarmer (LH) system, en 𝑋X-bånd linearizer, en bundkompressor (BC), 𝑆S-bånd og �
Ny tilgang til generering af sammenhængende og ultrakorte bløde røntgenimpulserSkematisk af EEHC eksperimentet. Den øverste strålelinje viser linacen, som består af en fotokatode rf pistol, et laservarmer (LH) system, en 𝑋X-bånd linearizer, en bundkompressor (BC), 𝑆S-bånd og � -
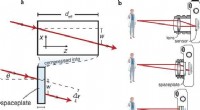 Sig farvel til din kamerabump:Miniaturiseret optik gennem ny modstykke til objektivDriftsprincip for en rumplade. en, En rumplade kan komprimere en forplantningslængde af deff til en tykkelse d. For eksempel, en stråle, der indfalder på rumpladen i vinkel θ, kommer frem i den samme
Sig farvel til din kamerabump:Miniaturiseret optik gennem ny modstykke til objektivDriftsprincip for en rumplade. en, En rumplade kan komprimere en forplantningslængde af deff til en tykkelse d. For eksempel, en stråle, der indfalder på rumpladen i vinkel θ, kommer frem i den samme -
 Hvorfor eksploderer frosne kalkuner, når de frituresteges?Når vand og kogende olie blandes, kan resultatet blive eksplosivt, som det ses i denne demonstration. Kredit:U.S. Navy foto af massekommunikationsspecialist 2nd Class Travis Alston/Udgivet via Flickr
Hvorfor eksploderer frosne kalkuner, når de frituresteges?Når vand og kogende olie blandes, kan resultatet blive eksplosivt, som det ses i denne demonstration. Kredit:U.S. Navy foto af massekommunikationsspecialist 2nd Class Travis Alston/Udgivet via Flickr -
 Matematisk nudling fører til ny indsigt i et gammelt fusionsproblemPPPL-fysiker Christopher Smiet hjalp med at producere resultater, der kunne bringe fusionsproduceret elektricitet tættere på at være en realitet. Kredit:Pamela Serai En udfordring ved at skabe fus
Matematisk nudling fører til ny indsigt i et gammelt fusionsproblemPPPL-fysiker Christopher Smiet hjalp med at producere resultater, der kunne bringe fusionsproduceret elektricitet tættere på at være en realitet. Kredit:Pamela Serai En udfordring ved at skabe fus
- Starship a vejer 2 ton og kræver en hastighed på ca. 11 km s for at flygte fra jorden hastigheden …
- Nyt modificeret CRISPR-protein kan passe ind i virus, der bruges til genterapi
- Hvad er de to slags gletsjere, og hvordan de er forskellige?
- Streetcars garanterer ikke øget udviklingsaktivitet, undersøgelse finder
- Hvilke stjerner er den ældste med hensyn til livscyklus?
- Hvor forekommer kontinental rifting i dag?


