Hvad gør Matter solid?
Stærke intermolekylære kræfter:
* kovalente obligationer: I faste stoffer som diamant og kvarts deler atomer elektroner til at danne stærke kovalente bindinger. Disse bindinger er den stærkeste type, hvilket fører til meget høje smeltepunkter og hårdhed.
* ioniske bindinger: I ioniske faste stoffer som bordsalt tiltrækker modsat ladede ioner hinanden stærkt. Disse elektrostatiske interaktioner er også ret stærke, hvilket giver disse faste stoffer høje smeltepunkter.
* Metalliske obligationer: Metaller har en unik binding, hvor elektroner delokaliseres og deles gennem hele strukturen. Dette resulterer i stærk tiltrækning og giver mulighed for fremragende elektrisk og termisk ledningsevne.
* Hydrogenbindinger: I mange faste stoffer danner hydrogenatomer særlige bindinger med stærkt elektronegative atomer som ilt og nitrogen. Disse bindinger er svagere end kovalente eller ioniske bindinger, men stadig markant stærkere end van der Waals -styrker.
* van der Waals Forces: Selv ikke-polære molekyler udviser svage attraktioner på grund af midlertidige udsving i elektrondensitet. Disse kræfter er meget svagere end kovalente, ioniske eller brintbindinger, men de spiller stadig en rolle i at holde faste partikler sammen.
Fast arrangement:
* Partikler i et fast stof er arrangeret i et stærkt ordnet, gentagne mønster kaldet A krystalgitter .
* Denne almindelige struktur giver faste stoffer deres konkrete form og volumen.
Begrænset bevægelse:
* Mens partikler i en solid vibrerer omkring deres faste positioner, kan de ikke bevæge sig frit som dem i en væske eller gas.
* Denne begrænsede bevægelse er grunden til, at faste stoffer har en høj densitet sammenlignet med væsker og gasser.
Key Takeaway: De stærke intermolekylære kræfter, der binder partikler i et fast arrangement og begrænser deres bevægelse, er det, der gør materien solid.
 Varme artikler
Varme artikler
-
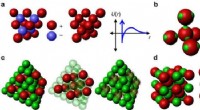 Ingeniører overvinder en forhindring i at udvikle et revolutionerende optisk metamaterialeroposed fremgangsmåder til fremstilling af diamantlignende kolloide krystaller. (a) Et simpelt diamantgitter kan stabiliseres ved at modsat ladede partikler indtager skiftevis gittersteder, eller med
Ingeniører overvinder en forhindring i at udvikle et revolutionerende optisk metamaterialeroposed fremgangsmåder til fremstilling af diamantlignende kolloide krystaller. (a) Et simpelt diamantgitter kan stabiliseres ved at modsat ladede partikler indtager skiftevis gittersteder, eller med -
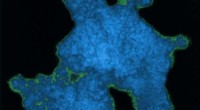 Sikke et meshDette viser elektronmikroskopi af tværbundne titania-nanopartikler med bor-baserede klynger. Argonne-forskere hjalp med at skabe en metode til at bygge disse netværk. Kredit:UCLA / Alexander Spokoyny.
Sikke et meshDette viser elektronmikroskopi af tværbundne titania-nanopartikler med bor-baserede klynger. Argonne-forskere hjalp med at skabe en metode til at bygge disse netværk. Kredit:UCLA / Alexander Spokoyny. -
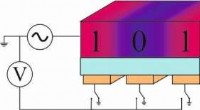 Energibesparende servere:Datalagring 2.0Diagram over en enhedsarkitektur, der anvender den piezoelektriske effekt. Kredit:Universitaet Mainz Uanset om det er at sende bedsteforældrene et par billeder af børnene, streame en film eller mu
Energibesparende servere:Datalagring 2.0Diagram over en enhedsarkitektur, der anvender den piezoelektriske effekt. Kredit:Universitaet Mainz Uanset om det er at sende bedsteforældrene et par billeder af børnene, streame en film eller mu -
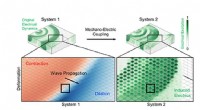 Visualisering af elektriske mønstre, der ligger til grund for unormale hjertesammentrækninger og d…Driften og responsen mellem det virtuelle hjerte (system 1) og det modellerede arytmiske hjerte (system 2). Kredit:University Medical Center Göttingen På trods af fremskridt inden for medicinsk bi
Visualisering af elektriske mønstre, der ligger til grund for unormale hjertesammentrækninger og d…Driften og responsen mellem det virtuelle hjerte (system 1) og det modellerede arytmiske hjerte (system 2). Kredit:University Medical Center Göttingen På trods af fremskridt inden for medicinsk bi
- Hvilken tilstand af stof ville acetone være i 42 graders Celsius?
- Er en spejl naturlig lysskilde?
- Hvad er bølgelængden af en foton med energi 1,06 x 10 -19?
- Hvilke er yngre gamle havbunden klipper eller kontinentale klipper?
- Hvad er underjordisk temperatur?
- Hvorfor er vi afhængige af solen for energi?


