Hvad sker der med en væske, når den fryser ved hjælp af partikelteorien?
1. Partikelbevægelse:
* væske: Partikler i en væske er relativt tæt på hinanden, men kan bevæge sig frit, konstant sprænge og kollidere med hinanden. Dette giver væsker deres evne til at flyde.
* Frysning: Når væsken afkøles, mister partiklerne energi. De bevæger sig langsommere og vibrerer mindre.
2. Attraktive kræfter:
* væske: I en væske er de attraktive kræfter mellem partikler stærke nok til at holde dem tæt sammen, men svage nok til at tillade bevægelse.
* Frysning: Når temperaturen falder nok, overvinder de attraktive kræfter mellem partikler den termiske energi (bevægelse). Dette får partiklerne til at arrangere sig selv i et mere ordnet, fast mønster.
3. Den faste tilstand:
* Frysning: I en solid er partikler tæt pakket og vibrerer i faste positioner. De kan ikke bevæge sig frit og give faste stoffer deres stivhed og form.
Kortfattet:
* Frysning er i det væsentlige en proces med at reducere partiklernes kinetiske energi. Dette gør det muligt for de attraktive kræfter at dominere, hvilket fører til en mere ordnet struktur med lavere mobilitet. Resultatet er en overgang fra en fritflydende væske til et stift, fastformet fast stof.
Yderligere noter:
* krystalstruktur: Det ordnede arrangement af partikler i et fast stof danner ofte et gentagende mønster kaldet en krystalgitter. Dette giver mange faste stoffer deres karakteristiske form og egenskaber.
* Undtagelser: Amorfe faste stoffer, som glas, har ikke en fast krystalstruktur, og deres partikler er arrangeret mere tilfældigt.
* densitet: Normalt er faste stoffer tættere end væsker, fordi partiklerne pakkes tættere sammen. Vand er imidlertid en bemærkelsesværdig undtagelse, hvor is er mindre tæt end flydende vand. Dette skyldes den unikke krystalstruktur af is.
Sidste artikelEr hastigheden af et objekt i UCM -konstant?
Næste artikelHvad er atomkraftmikroskop?
 Varme artikler
Varme artikler
-
 Forskere løser udfordringen med at forbedre fusionsydelsenSaskia Mordijck, en adjunkt i William &Marys fysikafdeling, ledet det multi-institutionelle forskerhold ved DIII-D National Fusion Facility, der udredede tre elementer i fusionsreaktionen. Deres arbej
Forskere løser udfordringen med at forbedre fusionsydelsenSaskia Mordijck, en adjunkt i William &Marys fysikafdeling, ledet det multi-institutionelle forskerhold ved DIII-D National Fusion Facility, der udredede tre elementer i fusionsreaktionen. Deres arbej -
 Matematik beskriver, hvordan bobler dukker opKredit:CC0 Public Domain At forstå dynamikken i sprængende bobler kan give kritisk indsigt for en række områder fra oceanografi til atmosfærisk videnskab, men de mekanismer, der driver den sidste
Matematik beskriver, hvordan bobler dukker opKredit:CC0 Public Domain At forstå dynamikken i sprængende bobler kan give kritisk indsigt for en række områder fra oceanografi til atmosfærisk videnskab, men de mekanismer, der driver den sidste -
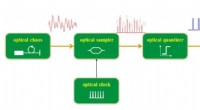 Fotoner kan aktivere fysisk tilfældig bitgenerering i realtid til informationssikkerhedsappUltrahurtige fysiske tilfældige bits kan genereres i realtid ved at kombinere bredbåndsfotoniske entropikilder med helt optiske signalbehandlingsteknikker. Kredit:Pu Li @TUT og GUT. Kryptografiske
Fotoner kan aktivere fysisk tilfældig bitgenerering i realtid til informationssikkerhedsappUltrahurtige fysiske tilfældige bits kan genereres i realtid ved at kombinere bredbåndsfotoniske entropikilder med helt optiske signalbehandlingsteknikker. Kredit:Pu Li @TUT og GUT. Kryptografiske -
 Svagt ækvivalensprincip krænket i gravitationsbølgerKredit:Pixabay/CC0 Public Domain Det svage ækvivalensprincip (WEP) er et nøgleaspekt af klassisk fysik. Den siger, at når partikler er i frit fald, de baner, de følger, er fuldstændig uafhængige a
Svagt ækvivalensprincip krænket i gravitationsbølgerKredit:Pixabay/CC0 Public Domain Det svage ækvivalensprincip (WEP) er et nøgleaspekt af klassisk fysik. Den siger, at når partikler er i frit fald, de baner, de følger, er fuldstændig uafhængige a
- Kulstofopsamlingsteknologi skrubber CO2 fra kraftværker som dykkerudstyr
- Tip til løsning af algebraiske ligninger
- Hvordan beregner man atomiciteten af ammoniumfosfat?
- Math Fair Projekter på Fibonacci Numbers
- Hvad er den kemiske formel for tri svovl pentoxid?
- Hvordan blinde hulefisk finder vej i mørket


