Hvordan afgiver atomer elektromagnetiske bølger?
1. Elektroner findes i energiniveau:
* Atomer har en kerne, der indeholder protoner og neutroner, og omgivelsen af denne kerne er en sky af elektroner.
* Elektroner findes i specifikke energiniveauer eller orbitaler. Disse niveauer er kvantiseret, hvilket betyder, at de kun kan have specifikke, diskrete mængder energi.
2. Spændt tilstand:
* Når et atom absorberer energi, for eksempel fra varme, lys eller kollisioner, kan dens elektroner hoppe til et højere energiniveau.
* Dette kaldes en ophidset tilstand . Elektronet er nu ustabilt og vil vende tilbage til et lavere energiniveau.
3. Emission af fotoner:
* For at vende tilbage til sit stabile, lavere energiniveau frigiver den ophidsede elektron den overskydende energi som en pakke med elektromagnetisk stråling kaldet A foton .
* Fotonens energi er nøjagtigt lig med forskellen i energi mellem de to niveauer.
4. Elektromagnetisk spektrum:
* Fotonens energi bestemmer dens frekvens, som igen bestemmer den type elektromagnetiske stråling, der udsendes.
* Fotoner med lav energi svarer til radiobølger, mens fotoner med høj energi svarer til gammastråler. Synligt lys falder et sted midt i spektret.
5. Typer af emission:
* spontan emission: Dette er den mest almindelige type emission. Den ophidsede elektron frigiver spontant en foton og vender tilbage til sin jordtilstand.
* Stimuleret emission: Dette sker, når en ekstern foton med den samme energi som energiforskellen mellem de ophidsede og jordtilstande interagerer med atomet. Denne interaktion stimulerer atomet til at udsende en anden foton med den samme energi og fase som den eksterne foton. Dette er princippet bag lasere.
Kortfattet:
Atomer udsender elektromagnetiske bølger, når deres elektroner overgår fra et højere energiniveau til et lavere energiniveau. Energiforskellen mellem disse niveauer bestemmer frekvensen (og derfor typen) af stråling, der udsendes.
 Varme artikler
Varme artikler
-
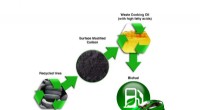 August 2017:Historietips fra Institut for Energys Oak Ridge National LaboratoryBrugt madolie kan omdannes til biobrændstof med kulstof afledt af genbrugsdæk-en ny metode udviklet af et Oak Ridge National Laboratory-ledet forskerteam. Kredit:Oak Ridge National Laboratory/Dept. af
August 2017:Historietips fra Institut for Energys Oak Ridge National LaboratoryBrugt madolie kan omdannes til biobrændstof med kulstof afledt af genbrugsdæk-en ny metode udviklet af et Oak Ridge National Laboratory-ledet forskerteam. Kredit:Oak Ridge National Laboratory/Dept. af -
 Team sætter det optiske mikroskop under mikroskopet for at opnå atomnøjagtighedDenne illustration viser en række åbninger med en afstand på 5000 nanometer (nm) ± 1 nm. Åbningerne passerer lys gennem en metalfilm på et objektglas. Billeddannelse af åbningsarrayet med et optisk mi
Team sætter det optiske mikroskop under mikroskopet for at opnå atomnøjagtighedDenne illustration viser en række åbninger med en afstand på 5000 nanometer (nm) ± 1 nm. Åbningerne passerer lys gennem en metalfilm på et objektglas. Billeddannelse af åbningsarrayet med et optisk mi -
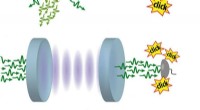 Fysikere observerer en ny kvanteeffekt, der begrænser antallet af udsendte fotonerKredit:MPQ, Quantum Dynamics Division Sandsynligheden for at finde et vist antal fotoner inde i en laserimpuls svarer normalt til en klassisk fordeling af uafhængige begivenheder, den såkaldte Poi
Fysikere observerer en ny kvanteeffekt, der begrænser antallet af udsendte fotonerKredit:MPQ, Quantum Dynamics Division Sandsynligheden for at finde et vist antal fotoner inde i en laserimpuls svarer normalt til en klassisk fordeling af uafhængige begivenheder, den såkaldte Poi -
 Flydende kulstof karakteriseret ved hjælp af en fri elektronlaserFemtosekund pumpe-sonde-impulser genererer og karakteriserer flydende kulstof for første gang i en FEL-facilitet. Kredit:Principi Fra almindelig sod til ædle diamanter, kulstof er kendt i mange af
Flydende kulstof karakteriseret ved hjælp af en fri elektronlaserFemtosekund pumpe-sonde-impulser genererer og karakteriserer flydende kulstof for første gang i en FEL-facilitet. Kredit:Principi Fra almindelig sod til ædle diamanter, kulstof er kendt i mange af
- Antal bølger produceret pr. Sekund?
- Hvad er et apparat, der konverterer elektrisk energi til kinetisk energi?
- Laserbaseret teknologi hjælper læger med at forestille sig fuldt øje i 3D
- Forholdet mellem alder og plasticitet
- Hvad er teoretisk effektivitet?
- Et bevægende objekt, der har en masse inerti vil?


