Hvor stærk er kraften mellem flydende partikler?
* faste stoffer: Partikler i faste stoffer holdes sammen af stærke intermolekylære kræfter (Som ioniske bindinger, kovalente bindinger eller metalliske bindinger). Disse kræfter holder partiklerne i faste positioner, hvilket giver faste stoffer deres stive struktur.
* væsker: Partikler i væsker har svagere intermolekylære kræfter end faste stoffer. Disse kræfter er stærke nok til at holde partiklerne tæt sammen, men ikke stærke nok til at holde dem i faste positioner. Dette giver væsker mulighed for at flyde og tage formen på deres beholder.
* Gasser: Partikler i gasser har meget svage intermolekylære kræfter . Disse kræfter er så svage, at partiklerne er langt fra hinanden og bevæger sig frit, hvilket resulterer i gasser, der tager hele volumen af deres beholder.
Typer af intermolekylære kræfter i væsker:
* Hydrogenbinding: Stærkeste type forekommer mellem molekyler indeholdende hydrogen bundet til et stærkt elektronegativt atom som ilt, nitrogen eller fluor.
* dipol-dipolinteraktioner: Forekommer mellem polære molekyler på grund af deres permanente dipoler.
* London Dispersion Forces: Svageste type forekommer mellem alle molekyler på grund af midlertidige udsving i elektronfordeling.
Styrken af disse kræfter afhænger af flyvetypen og dens kemiske struktur. For eksempel har vand stærk hydrogenbinding, hvilket gør det til en væske ved stuetemperatur, mens metan kun har svage London -spredningskræfter, hvilket gør det til en gas.
Kortfattet:
Væsker har mellemliggende Intermolekylære kræfter, svagere end faste stoffer, men stærkere end gasser. Dette giver dem mulighed for at flyde og tage formen på deres beholder, mens de stadig opretholder en vis samhørighed mellem partikler.
 Varme artikler
Varme artikler
-
 Forskere måler elektronspin-qubit uden at ødelægge detKredit:CC0 Public Domain En gruppe forskere fra RIKEN Center for Emergent Matter Science i Japan er lykkedes med at tage gentagne målinger af en elektrons spin i en siliciumkvanteprik (QD) uden at
Forskere måler elektronspin-qubit uden at ødelægge detKredit:CC0 Public Domain En gruppe forskere fra RIKEN Center for Emergent Matter Science i Japan er lykkedes med at tage gentagne målinger af en elektrons spin i en siliciumkvanteprik (QD) uden at -
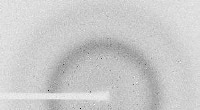 En offentlig database over makromolekylære diffraktionsforsøgHver prik dannes fra den konstruktive interferens af røntgenstråler, der passerer gennem en krystal. Dataene kan bruges til at undersøge krystallens struktur. Kredit:M. Grabowski et al. Reproducer
En offentlig database over makromolekylære diffraktionsforsøgHver prik dannes fra den konstruktive interferens af røntgenstråler, der passerer gennem en krystal. Dataene kan bruges til at undersøge krystallens struktur. Kredit:M. Grabowski et al. Reproducer -
 Forståelse af ionisering af protonpåvirket heliumKredit:Pixabay/CC0 Public Domain Avanceret matematisk analyse af ioniseringen af et heliumatom af en påvirkende proton har afsløret, hvor der opstår uoverensstemmelser mellem eksperimenter og ek
Forståelse af ionisering af protonpåvirket heliumKredit:Pixabay/CC0 Public Domain Avanceret matematisk analyse af ioniseringen af et heliumatom af en påvirkende proton har afsløret, hvor der opstår uoverensstemmelser mellem eksperimenter og ek -
 Lysemitterende silicium til fotonisk databehandlingEindhoven University of Technology, forskerne Elham Fadaly (til venstre) og Alain Dijkstra (til højre) med deres opsætning til måling af lysemission fra en silicium-germaniumprøve med sekskantet kryst
Lysemitterende silicium til fotonisk databehandlingEindhoven University of Technology, forskerne Elham Fadaly (til venstre) og Alain Dijkstra (til højre) med deres opsætning til måling af lysemission fra en silicium-germaniumprøve med sekskantet kryst


