Hvordan forbereder du 0,02M NaOH-opløsning?
1. Beregn den nødvendige mængde NaOH.
$$Molaritet =\frac{Moles\ of\ NaOH}{Liters\ of\ Solution}$$
Omarrangering af formlen for at løse for mol NaOH:
$$Moler \ af \ NaOH \ =Molaritet \ gange liter\ af\ Solution$$
$$Moler \ af \ NaOH =0,02 \ M \ gange 1 \ L=0,002 \ mol\ NaOH$$
2. Afvej den nødvendige mængde NaOH.
Molekylvægten af NaOH er ca. 40 g/mol. For at få 0,002 mol NaOH i gram:
$$ Masse \ af \ NaOH \ =Mol\ af\ NaOH \ gange molekylær\ Vægt $$
$$ Masse \ af \ NaOH \ =0,002 \ mol \ gange 40 \ g/mol =0,08 \ g$$
3. Opløs NaOH i en lille mængde vand.
Tilsæt forsigtigt 0,08 g NaOH til ca. 100 ml destilleret vand i et bægerglas. Rør indtil NaOH er helt opløst.
4. Overfør opløsningen til en 1-liters målekolbe
Brug en målecylinder til at overføre NaOH-opløsningen til en 1-liters målekolbe. Skyl bægerglasset med en lille mængde destilleret vand og tilsæt det til kolben.
5. Fyld kolben til 1-liters mærket med destilleret vand.
Tilsæt destilleret vand til kolben, indtil niveauet når 1-liters mærket. Rør forsigtigt kolben rundt for at blande opløsningen.
6. Bland opløsningen grundigt.
Sæt låg på målekolben og vend den flere gange for at sikre, at opløsningen er godt blandet.
Nu har du 1 liter 0,02M NaOH-opløsning. Opbevar opløsningen i en ren, mærket flaske ved stuetemperatur.
Husk at bære passende sikkerhedsudstyr, inklusive handsker og øjenværn, når du håndterer NaOH. NaOH er et ætsende stof og kan forårsage alvorlige forbrændinger og skader, hvis det ikke håndteres med varsomhed.
Sidste artikelHVORDAN MAN 0,1N NaOH opløsning forberedelse?
Næste artikelHvad er en tyndall-effekt i kemi?
 Varme artikler
Varme artikler
-
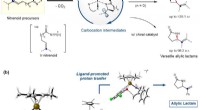 Ny katalytisk tilgang til adgang til nøglemellemkarbokation98%). (b) Beregningsmodellering til at bevise mellemvirkningen af carbocation og for at forstå det selektivitetsbestemmende trin. Kredit:IBS Den menneskelige civilisation i det 21. århundrede er
Ny katalytisk tilgang til adgang til nøglemellemkarbokation98%). (b) Beregningsmodellering til at bevise mellemvirkningen af carbocation og for at forstå det selektivitetsbestemmende trin. Kredit:IBS Den menneskelige civilisation i det 21. århundrede er -
 Elektrokemisk reaktion driver nye lægemiddelfundKredit:CC0 Public Domain Et Cornell-ledet samarbejde vender omskifteren til traditionel syntetisk kemi ved at bruge elektricitet til at drive en ny kemisk reaktion, der tidligere stubbe kemikere,
Elektrokemisk reaktion driver nye lægemiddelfundKredit:CC0 Public Domain Et Cornell-ledet samarbejde vender omskifteren til traditionel syntetisk kemi ved at bruge elektricitet til at drive en ny kemisk reaktion, der tidligere stubbe kemikere, -
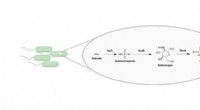 Kemikere afslører den første vej for selenindsættelse i naturlige produkterDenne illustration viser den biosyntetiske vej, der inkorporerer Se i mikrobielle små molekyler, som peger mod et uudnyttet kemisk rum i bakterier, der nu kan udvindes for nye naturlige produkter. Kre
Kemikere afslører den første vej for selenindsættelse i naturlige produkterDenne illustration viser den biosyntetiske vej, der inkorporerer Se i mikrobielle små molekyler, som peger mod et uudnyttet kemisk rum i bakterier, der nu kan udvindes for nye naturlige produkter. Kre -
 Forskere opdager gener, der hjælper skadelige bakterier til at modarbejde behandlingMethicillinresistent Staphylococcus aureus (MRSA). Kredit:Amerikanske centre for sygdomsbekæmpelse og forebyggelse Et Rutgers-ledet team har opdaget to gener, der gør nogle stammer af skadelige
Forskere opdager gener, der hjælper skadelige bakterier til at modarbejde behandlingMethicillinresistent Staphylococcus aureus (MRSA). Kredit:Amerikanske centre for sygdomsbekæmpelse og forebyggelse Et Rutgers-ledet team har opdaget to gener, der gør nogle stammer af skadelige
- Beskyttelse af menneskelig arv på månen:Lad ikke et lille skridt blive til en kæmpe fejltagelse
- Hvordan en verdensrekord 'squeeze' kunne tilbyde komfort for mørkt stofjægere
- Sådan laver du et simpelt kredsløb for børn Brug af et batteri og Wire
- Fysikere kvantificerer temperaturændringer i metal nanotråde
- US Navy øjne grafen nanobånd for ultimativt magt kontrolsystem
- Forskere finder rekordvarmt vand i Antarktis, peger på årsag bag bekymrende gletsjersmeltning


