Hvilken tilstand af stof har de stærkeste kræfter tiltrækning mellem partikler?
Her er hvorfor:
* faste stoffer: Partikler i faste stoffer er tæt pakket sammen og vibrerer i faste positioner. De stærke attraktive kræfter mellem partikler holder dem låst i en stiv struktur, hvilket giver faste stoffer deres konkrete form og volumen.
* væsker: Partikler i væsker er mere løst pakket end faste stoffer, så de kan bevæge sig rundt og glide forbi hinanden. Tiltrækningskræfterne er svagere end i faste stoffer, men stadig betydningsfulde nok til at opretholde et bestemt volumen.
* Gasser: Partikler i gasser er vidt adskilt og bevæger sig frit. Kræfterne til tiltrækning mellem partikler er meget svage, hvilket gør det muligt for gasser at udvide for at fylde deres beholder.
Tænk på det på denne måde: Forestil dig en gruppe mennesker, der holder hænder.
* fast: De er alle tæt pakket sammen og holder hænderne fast, hvilket gør det vanskeligt at bevæge sig.
* væske: De holder stadig hænder, men mere løst, så de kan blande sig lidt rundt.
* gas: De er alle spredt, næppe holder hænder og bevæger sig frit.
 Varme artikler
Varme artikler
-
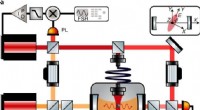 Demonstrer vektorielle polaritoner ved at svæve en nanosfære inde i et optisk hulrumFigur 1. Kredit:DOI:10.1038/s41567-021-01307-y Et team af forskere fra European Laboratory for Non-linear Spectroscopy, INFN, Sezione di Firenze og Università di Firenze har demonstreret en form f
Demonstrer vektorielle polaritoner ved at svæve en nanosfære inde i et optisk hulrumFigur 1. Kredit:DOI:10.1038/s41567-021-01307-y Et team af forskere fra European Laboratory for Non-linear Spectroscopy, INFN, Sezione di Firenze og Università di Firenze har demonstreret en form f -
 Ultra-lille nanokavitet udvikler teknologi til sikker kvantebaseret datakrypteringDenne stiliserede gengivelse af tværsnittet af den metalliske hybrid-nanokavitet koblet til en kvantepunkt viser lodret emission til frit rum. Kredit:Yousif Kelaita, Stanford University Forskere h
Ultra-lille nanokavitet udvikler teknologi til sikker kvantebaseret datakrypteringDenne stiliserede gengivelse af tværsnittet af den metalliske hybrid-nanokavitet koblet til en kvantepunkt viser lodret emission til frit rum. Kredit:Yousif Kelaita, Stanford University Forskere h -
 Forskere forfiner søgen efter mørkt stofMørkt stofkort over KiDS undersøgelsesregion (region G12). Kredit:KiDS undersøgelse Forskere fra Lunds Universitet i Sverige, blandt andre, har udviklet en mere effektiv teknik i søgen efter spor
Forskere forfiner søgen efter mørkt stofMørkt stofkort over KiDS undersøgelsesregion (region G12). Kredit:KiDS undersøgelse Forskere fra Lunds Universitet i Sverige, blandt andre, har udviklet en mere effektiv teknik i søgen efter spor -
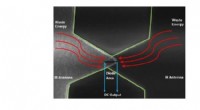 Innovativt diodedesign bruger ultrahurtig kvantetunneling til at høste infrarød energi fra miljøe…Overlappende metalarme formet som en sløjfe danner en rectenna, der fanger fri, vedvarende infrarød energi. Kredit:Atif Shamim Det meste sollys, der rammer Jorden, absorberes af dets overflader, o
Innovativt diodedesign bruger ultrahurtig kvantetunneling til at høste infrarød energi fra miljøe…Overlappende metalarme formet som en sløjfe danner en rectenna, der fanger fri, vedvarende infrarød energi. Kredit:Atif Shamim Det meste sollys, der rammer Jorden, absorberes af dets overflader, o
- Hvilken type forbindelse er natriumklor?
- Katodisk korrosion - ødelæggende, men forudsigelig
- Hvorfor kaldes natriumchloridet som NaCl?
- Hvilke 3 lande er mest afhængige af atomenergi?
- Hvilke dele af spektret absorberer chlorophyll bedst?
- Hvad opstår, når vandfrit natriumcarbonat reagerer med saltsyre?


