Hvilken videnskabsmand foreslog, at elektroner har faste kredsløb?
I 1913 foreslog Bohr sin bohr -model af atomet, som var et betydeligt skridt fremad med at forstå atomstrukturen. Han foreslog det:
* Elektroner kredserer kernen i specifikke, kvantiserede energiniveauer.
* Disse kredsløb er cirkulære og har faste radier, hvilket betyder, at elektroner kun kan eksistere i visse afstande fra kernen.
* Elektroner kan hoppe mellem disse kredsløb ved at absorbere eller udsende fotoner af specifikke energier.
Mens Bohrs model var et værdifuldt bidrag og med succes forklarede nogle atomfænomener, blev den senere erstattet af den mere nøjagtige kvantemekaniske model af atomet. Kvantemodellen beskriver elektroner som bølglignende partikler, der findes i sandsynlighedskyer snarere end faste kredsløb.
 Varme artikler
Varme artikler
-
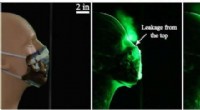 Ansigtsmaske konstruktion, materialer til at modvirke hoste, nysende dråberMed den syede quiltede bomuldsmaske, dråber rejste 2,5 tommer. Kredit:Florida Atlantic University, College for Ingeniør og Datalogi I øjeblikket, der er ingen specifikke retningslinjer for de mest
Ansigtsmaske konstruktion, materialer til at modvirke hoste, nysende dråberMed den syede quiltede bomuldsmaske, dråber rejste 2,5 tommer. Kredit:Florida Atlantic University, College for Ingeniør og Datalogi I øjeblikket, der er ingen specifikke retningslinjer for de mest -
 Rekordeffektivitet i tyndfilm solcellecellerTynd Si-membran absorberer 65% af sollys. Fremstillet i 3D fotovoltaik laboratorium. Kredit:AMOLF Siliciumsolceller har vist sig at være en top solcelleteknologi, da de bruger jordrige råmaterialer
Rekordeffektivitet i tyndfilm solcellecellerTynd Si-membran absorberer 65% af sollys. Fremstillet i 3D fotovoltaik laboratorium. Kredit:AMOLF Siliciumsolceller har vist sig at være en top solcelleteknologi, da de bruger jordrige råmaterialer -
 Kortlægning af kvantestrukturer med lys for at låse deres muligheder opKvantekamme belyst:Ved lys excitation (røde og gule bjælker), elektroner opdages for at danne kamlignende bølgemønstre. Kamlinjernes smalle bredde gør det muligt at detektere (belyste toppe) billeder
Kortlægning af kvantestrukturer med lys for at låse deres muligheder opKvantekamme belyst:Ved lys excitation (røde og gule bjælker), elektroner opdages for at danne kamlignende bølgemønstre. Kamlinjernes smalle bredde gør det muligt at detektere (belyste toppe) billeder -
 Superkrystal:En skjult fase af stof skabt af et lysudbrudEt 3D-billede af en superkrystal fra fasefeltsimuleringer ved hjælp af softwaren μ-PRO. Kredit:L-Q Chen Group, Penn State Frustration plus en puls af laserlys resulterede i en stabil superkrystal
Superkrystal:En skjult fase af stof skabt af et lysudbrudEt 3D-billede af en superkrystal fra fasefeltsimuleringer ved hjælp af softwaren μ-PRO. Kredit:L-Q Chen Group, Penn State Frustration plus en puls af laserlys resulterede i en stabil superkrystal
- Hvad var Star Orion kendt som armhulen af kæmpe?
- Hvad er et eksempel på interaktion mellem energisoffer?
- Billede:Gulf of Kutch, Indien
- Hvordan bruger forskere til at bestemme alderen på en klippe på havbunden?
- Længere pendling påvirker leveomkostningerne i store byer mere end zoneinddelingsrestriktioner
- Hvad er sammensætningen og strukturen af selen?


