Hvad er forholdet mellem gastemperatur og hastighed af partikler i en beholder?
Her er en sammenbrud:
* kinetisk molekylær teori: Denne teori siger, at temperaturen på en gas er direkte proportional med den gennemsnitlige kinetiske energi for dens partikler. Kinetisk energi er bevægelsesenergien.
* kinetisk energi og hastighed: Den kinetiske energi i en partikel er relateret til dens masse og hastighed ved ligningen:Ke =1/2 * mv^2.
* Temperatur og gennemsnitlig hastighed: Da kinetisk energi er proportional med temperaturen, og kinetisk energi er relateret til hastighed, kan vi konkludere, at temperaturen også er direkte proportional med den gennemsnitlige hastighed for gaspartikler.
i enklere termer:
* Når du opvarmer en gas, giver du dens partikler mere energi.
* Denne øgede energi får partiklerne til at bevæge sig hurtigere, hvilket resulterer i en højere gennemsnitlig hastighed.
Vigtige noter:
* Dette forhold gælder kun for * gennemsnitlig * hastighed. Individuelle partikler i en gas vil have forskellige hastigheder på grund af tilfældige kollisioner.
* Forholdet er ikke lineært . En fordobling af temperaturen betyder ikke nødvendigvis en fordobling af hastighed.
* Dette forhold gælder for ideelle gasser. Ægte gasser kan udvise nogle afvigelser fra denne opførsel ved meget høje tryk eller lave temperaturer.
Eksempler:
* En varmluftsballon stiger, fordi den opvarmede luft indeni har en højere gennemsnitlig hastighed, hvilket gør den mindre tæt end den omgivende kolde luft.
* Lydens hastighed i en gas er direkte relateret til den gennemsnitlige hastighed for dens partikler, og det er grunden til, at lyd bevæger sig hurtigere i varmere luft.
Fortæl mig, hvis du har andre spørgsmål!
 Varme artikler
Varme artikler
-
 Hukommelseslager til superkold computingORNL-udviklede kryogene hukommelsescellekredsløbsdesign fremstillet på disse små chips af SeeQC, et superledende teknologivirksomhed, vellykket demonstreret læst, skrive og nulstille hukommelsesfunkti
Hukommelseslager til superkold computingORNL-udviklede kryogene hukommelsescellekredsløbsdesign fremstillet på disse små chips af SeeQC, et superledende teknologivirksomhed, vellykket demonstreret læst, skrive og nulstille hukommelsesfunkti -
 Teorier beskriver dynamisk uordnede faste materialerJohan Klarbring, Linköpings universitet. Kredit:Thor Balkhed Teoretiske fysikere ved Linköpings universitet har udviklet en beregningsmetode til beregning af overgangen fra en fase til en anden i
Teorier beskriver dynamisk uordnede faste materialerJohan Klarbring, Linköpings universitet. Kredit:Thor Balkhed Teoretiske fysikere ved Linköpings universitet har udviklet en beregningsmetode til beregning af overgangen fra en fase til en anden i -
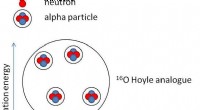 Findes der alfapartikelkondensater i iltkerner?Billedrepræsentation af ilt-16 (16O) grundtilstand og den Hoyle-lignende tilstand. Kredit:Texas A&M University Kerner i deres laveste energitilstande (grundtilstand) består af neutroner og protone
Findes der alfapartikelkondensater i iltkerner?Billedrepræsentation af ilt-16 (16O) grundtilstand og den Hoyle-lignende tilstand. Kredit:Texas A&M University Kerner i deres laveste energitilstande (grundtilstand) består af neutroner og protone -
 Simuleringer undersøger materialers ydeevne i NIF-eksperimenterDisse billeder viser beregnet lasereffekt pr. arealenhed på kapseloverfladen, der blev brugt i eksperimenterne. De sorte prikker angiver pegningen på kapseloverfladen. Kredit:Lawrence Livermore Nation
Simuleringer undersøger materialers ydeevne i NIF-eksperimenterDisse billeder viser beregnet lasereffekt pr. arealenhed på kapseloverfladen, der blev brugt i eksperimenterne. De sorte prikker angiver pegningen på kapseloverfladen. Kredit:Lawrence Livermore Nation
- Hvad påvirker sammensætningen af et vand dets ladning?
- 3-D-printet mad kan ændre, hvordan vi spiser
- Er månen i dit solsystem?
- DNA fra en gammel, uidentificeret forfader blev overført til mennesker, der lever i dag
- Forskere udforsker komplekse kulhydrater for at beskytte vandkvaliteten
- Intracellulære temperatursensorer:Proteinkompleks udviser temperaturfølsom aktivitet


