Hvad er meningen med termisk hastighed?
Her er en sammenbrud:
* termisk energi: Dette er energien forbundet med tilfældig bevægelse af partikler i et stof. Jo højere temperatur, jo mere termisk energi har partiklerne.
* Tilfældig bevægelse: Partikler i en gas bevæger sig konstant i alle retninger og kolliderer med hinanden og væggene i deres beholder.
* Gennemsnitlig hastighed: Termisk hastighed repræsenterer den gennemsnitlige hastighed for alle disse tilfældigt bevægende partikler. Det er ikke hastigheden for nogen individuel partikel, men snarere et statistisk gennemsnit.
Nøglepunkter:
* Højere temperatur, højere termisk hastighed: Jo varmere gassen er, jo hurtigere bevæger partiklerne sig, hvilket fører til en højere termisk hastighed.
* relateret til kinetisk energi: Termisk hastighed er direkte relateret til partiklernes kinetiske energi. Kinetisk energi er bevægelsesenergien, og en højere termisk hastighed betyder højere kinetisk energi.
* Brugt i gasdynamik: Termisk hastighed er et vigtigt koncept i gasdynamik, der bruges til at forstå fænomener som diffusion, varmeoverførsel og tryk.
Formel:
Den termiske hastighed (V) af en partikel i en gas gives af:
v =√ (3kt/m)
Hvor:
* K =Boltzmann Constant (1.380649 × 10^-23 J/K)
* T =temperatur i Kelvin
* m =masse af partiklen
Eksempel:
Forestil dig en beholder med gas ved stuetemperatur. Gasmolekylernes termiske hastighed ville være relativt lav. Hvis vi opvarmer gassen, vil den termiske hastighed øges, fordi molekylerne bevæger sig hurtigere.
Kort sagt er termisk hastighed en måde at forstå den gennemsnitlige hastighed på partikler i en gas på grund af deres termiske energi, og det spiller en betydelig rolle i forståelsen af, hvordan gasser opfører sig.
 Varme artikler
Varme artikler
-
 Forskere knækker kvantefysik -puslespilKredit:Zak Sakata på Unsplash Forskere har genundersøgt en 60-årig idé af en amerikansk fysiker og givet ny indsigt i kvanteverdenen. Forskningen, som tog syv år at gennemføre, kan føre til forbe
Forskere knækker kvantefysik -puslespilKredit:Zak Sakata på Unsplash Forskere har genundersøgt en 60-årig idé af en amerikansk fysiker og givet ny indsigt i kvanteverdenen. Forskningen, som tog syv år at gennemføre, kan føre til forbe -
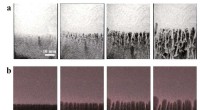 Forskning identificerer nøgleforbindelsen mellem gravitationel ustabilitet i fysiske geler og granu…Når sandlejer (a) og geler (b) er destabiliserede, ses lignende finger-ustabiliteter dannes over tid (venstre mod højre). Kredit:Tokyo Metropolitan University Forskere fra Tokyo Metropolitan Univer
Forskning identificerer nøgleforbindelsen mellem gravitationel ustabilitet i fysiske geler og granu…Når sandlejer (a) og geler (b) er destabiliserede, ses lignende finger-ustabiliteter dannes over tid (venstre mod højre). Kredit:Tokyo Metropolitan University Forskere fra Tokyo Metropolitan Univer -
 Fysiker forsvarer gyldigheden af Stokes-Einstein-ligningen i levende systemerTemperaturafhængighed af HNS-diffusion i levende og døde E. coli. (a),(b) MSD af HNS i (a) levende og (b) døde E. coli ved forskellige temperaturer. Stiplede linjer er tilpassede kurver ved hjælp af M
Fysiker forsvarer gyldigheden af Stokes-Einstein-ligningen i levende systemerTemperaturafhængighed af HNS-diffusion i levende og døde E. coli. (a),(b) MSD af HNS i (a) levende og (b) døde E. coli ved forskellige temperaturer. Stiplede linjer er tilpassede kurver ved hjælp af M -
 Brug af hajvægte til at designe bedre droner, fly, og vindmøllerEt team af evolutionære biologer og ingeniører ved Harvard, har demonstreret en ny, struktur inspireret af hajskind, der kunne forbedre flyenes aerodynamiske ydeevne, vindturbine, droner og biler. Kre
Brug af hajvægte til at designe bedre droner, fly, og vindmøllerEt team af evolutionære biologer og ingeniører ved Harvard, har demonstreret en ny, struktur inspireret af hajskind, der kunne forbedre flyenes aerodynamiske ydeevne, vindturbine, droner og biler. Kre
- Hvilket lag af jorden kommer geotermisk energi fra?
- Er disse små, iboende sikre atomreaktorer vejen til en kulstoffri fremtid?
- Hvad er klassificeringen for en stor seje stjerner?
- Gameter er haploide, mens somatiske celler diploide Hvad er forskellen mellem en celle og celle?
- Ny tilgang udviklet til elektrokatalytisk H₂O₂-produktion og biomasseopgradering
- Forskning tyder på at spise bønner i stedet for oksekød ville reducere drivhusgasserne kraftigt


