Hvilken model bruger forskere i dag til at beskrive, hvordan elektroner bevæger sig rundt i kernen?
* Elektroner har bølgepartikel-dualitet: De udviser både bølge-lignende og partikellignende egenskaber.
* Electrons position og momentum kan ikke kendes samtidig med sikkerhed: Dette er kendt som Heisenberg -usikkerhedsprincippet.
* Elektroner besætter specifikke energiniveauer: Disse niveauer er kvantiseret, hvilket betyder, at de kun kan eksistere ved diskrete energiforhold.
* Elektroner er beskrevet af sandsynlighedsfordelinger: Dette betyder, at vi ikke kan forudsige den nøjagtige placering af et elektron på ethvert givet tidspunkt, men vi kan beregne sandsynligheden for at finde det i et specifikt rumområde.
nøglefunktioner i den kvantemekaniske model:
* orbitaler: Elektroner besætter regioner i rummet kaldet orbitaler, som er defineret af deres form og energiniveau.
* hovedkantenummer (n): Angiver energiniveauet for orbitalen. Højere N -værdier svarer til højere energiniveau.
* vinkelmomentumnummer (L): Bestemmer formen på orbitalen (f.eks. Sfærisk, håndvægtformet).
* Magnetisk kvantenummer (ML): Definerer orienteringen af orbitalen i rummet.
* spin kvantenummer (MS): Beskriver elektronets iboende vinkelmoment, der er kvantiseret og kan enten spines op eller spin ned.
Den kvantemekaniske model er mere nøjagtig end tidligere modeller, såsom BoHR -modellen, fordi den kan forklare et bredere udvalg af fænomener, herunder:
* Atomernes kemiske binding og reaktivitet.
* Spectra of Light udsendes og absorberes af atomer.
* Eksistensen af forskellige isotoper af et element.
Selvom det stadig er et igangværende arbejde, er den kvantemekaniske model vores bedste forståelse af, hvordan elektroner opfører sig i atomer. Det giver et kraftfuldt værktøj til forståelse og forudsigelse af materialens egenskaber.
Sidste artikelKan du ændre stoftilstanden ved at røre ved partikler?
Næste artikelHvad er kraft, når 2 overflader er i kontakt?
 Varme artikler
Varme artikler
-
 Forskerhold bestemmer, hvordan elektronspin interagerer med krystalgitter i nikkeloxidKredit:University of California - Riverside Forskere ved UC Riverside brugte en ukonventionel tilgang til at bestemme styrken af elektronspin-interaktionerne med de optiske fononer i antiferroma
Forskerhold bestemmer, hvordan elektronspin interagerer med krystalgitter i nikkeloxidKredit:University of California - Riverside Forskere ved UC Riverside brugte en ukonventionel tilgang til at bestemme styrken af elektronspin-interaktionerne med de optiske fononer i antiferroma -
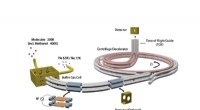 Kolde molekyler på kollisionskursSkematisk visning af den eksperimentelle opsætning af cryofugen. Kredit:MPQ, Quantum Dynamics Division Hvordan forløber kemiske reaktioner ved ekstremt lave temperaturer? Svaret kræver undersøgels
Kolde molekyler på kollisionskursSkematisk visning af den eksperimentelle opsætning af cryofugen. Kredit:MPQ, Quantum Dynamics Division Hvordan forløber kemiske reaktioner ved ekstremt lave temperaturer? Svaret kræver undersøgels -
 En bølgeleder med nulindeks:Forskere observerer direkte uendeligt lange bølgelængder for første …En bølgeleder med nulindeks, der er kompatibel med nuværende fotoniske siliciumteknologier. Kredit:Second Bay Studios/Harvard SEAS I 2015, forskere ved Harvard John A. Paulson School of Engineerin
En bølgeleder med nulindeks:Forskere observerer direkte uendeligt lange bølgelængder for første …En bølgeleder med nulindeks, der er kompatibel med nuværende fotoniske siliciumteknologier. Kredit:Second Bay Studios/Harvard SEAS I 2015, forskere ved Harvard John A. Paulson School of Engineerin -
 NIST forbedrer Johnson-støj termometrisystemDen 1 cm 2 mikrochip brugt til NISTs Johnson Noise Thermometri-arbejde, fremstillet ved Boulder, Colo., universitetsområde. NIST har for nylig foretaget væsentlige forbedringer af sit Johnson-st
NIST forbedrer Johnson-støj termometrisystemDen 1 cm 2 mikrochip brugt til NISTs Johnson Noise Thermometri-arbejde, fremstillet ved Boulder, Colo., universitetsområde. NIST har for nylig foretaget væsentlige forbedringer af sit Johnson-st
- Betyder familien noget i erhvervslivet? Undersøgelse evaluerer ejerskab til virksomheders miljøstr…
- Hvordan er klimatografier nyttige i forståelsen af biome?
- Fire største forskelle mellem Ocean & Fresh Water
- Hvad er et punkt i energiudgivelse?
- Har havforsuring forårsaget udryddelse af marine bløddyr?
- Hvilke fødevarer spiser dyr i tundraen?


