Hvad bidrog Daltons -teorien til videnskab?
1. Et fundament for kemi:
- atomer som byggesten: Dalton foreslog, at al sag består af små, udelelige partikler kaldet atomer. Denne enkle, men dybe idé gav en ramme for at forstå stoffets sammensætning og opførsel.
- elementer som unikke typer atomer: Han erkendte, at hvert element er sammensat af en unik type atom med en bestemt masse. Dette banede vejen for udviklingen af den periodiske tabel.
- kemiske reaktioner som omarrangementer: Daltons teori forklarede kemiske reaktioner som omarrangement af atomer snarere end skabelsen eller ødelæggelsen af stof. Dette koncept er nu kendt som loven om bevarelse af masse.
2. Kvantitativ analyse:
- Lov om flere proportioner: Dalton observerede, at når to elementer kombineres for at danne forskellige forbindelser, er masserne af det ene element, der kombineres med en fast masse af det andet element, i enkle forhold mellem hele antal. Denne lov gav en måde at forudsige formlerne af forbindelser og var en hjørnesten i kemisk støkiometri.
3. Forståelse af kemiske reaktioner:
- Forudsigelse af kemiske reaktioner: Daltons teori kombineret med sine love i flere proportioner gjorde det muligt for forskere at forudsige produkter og mængder af kemiske reaktioner og i høj grad fremme området med kemisk syntese.
4. Åbningsdøre til fremtidige opdagelser:
- Foundation for yderligere efterforskning: Mens Daltons teori ikke var perfekt (atomer kan deles i subatomære partikler), gav det et robust udgangspunkt for fremtidige opdagelser som arten af atomets struktur, isotoper og kvantemekanik.
Sammenfattende gav Daltons atomteori kemi et solidt fundament, banede vejen for kvantitativ analyse af reaktioner og åbnede dørene til yderligere efterforskning og opdagelser inden for materien.
 Varme artikler
Varme artikler
-
 Bagud i kvantecomputerræset, Tyskland får løft fra IBMguvernøren i Baden-Wuerttemberg, Winfried Kretschmann, forrest til venstre, og Martin Jetter, forrest til højre, CEO for IBM Europe, deltage i den officielle indvielse af den første kommercielt brugte
Bagud i kvantecomputerræset, Tyskland får løft fra IBMguvernøren i Baden-Wuerttemberg, Winfried Kretschmann, forrest til venstre, og Martin Jetter, forrest til højre, CEO for IBM Europe, deltage i den officielle indvielse af den første kommercielt brugte -
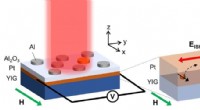 Spin-nuværende generation får mid-infrarød boost med plasmonisk metamaterialeEn gengivelse af PMA spintronic-enheden, der viser fotoinduceret spændingsgenerering ved foto-spin-voltaic (PSV) -effekten og den langsgående spin Seebeck-effekt (LSSE). Kredit:Satoshi Ishii I løb
Spin-nuværende generation får mid-infrarød boost med plasmonisk metamaterialeEn gengivelse af PMA spintronic-enheden, der viser fotoinduceret spændingsgenerering ved foto-spin-voltaic (PSV) -effekten og den langsgående spin Seebeck-effekt (LSSE). Kredit:Satoshi Ishii I løb -
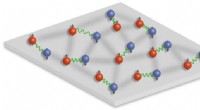 Fysikere finder tegn på en eksotisk tilstandI et kendt og velforstået scenario, parring skyldes udelukkende tiltrækningen mellem to fermioner (grønne linjer). Imidlertid, Heidelberg -forskere fandt ud af, at med stærke vekselvirkninger mellem f
Fysikere finder tegn på en eksotisk tilstandI et kendt og velforstået scenario, parring skyldes udelukkende tiltrækningen mellem to fermioner (grønne linjer). Imidlertid, Heidelberg -forskere fandt ud af, at med stærke vekselvirkninger mellem f -
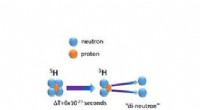 Forskere undersøger usædvanlige og ekstremt kortlivede brintarterEn ekstremt kortvarig 5 H -kernen henfalder efter kun tres billioner af en billioner af et sekund (6x10 -23 sekunder eller 60 yocto-sekunder) ved at udsende to neutroner sammen i en tilstand kendt
Forskere undersøger usædvanlige og ekstremt kortlivede brintarterEn ekstremt kortvarig 5 H -kernen henfalder efter kun tres billioner af en billioner af et sekund (6x10 -23 sekunder eller 60 yocto-sekunder) ved at udsende to neutroner sammen i en tilstand kendt
- Forskere opdager, hvordan man kan slå munkeparakitter ved deres eget spil
- Hvordan virker interferens i bølger?
- Hvad er ISBN for den flyvende cirkusfysik?
- Hvordan balanserer du S HNO3 giver H2SO4 NO2 H2O?
- Hvilke materialer isolerer elektricitet?
- 'City killers' og halvgiraffer:Hvor mange skræmmende asteroider går egentlig forbi Jorden hvert å…


