Hvorfor øger hurtigere bevægelige partikler reaktionshastigheden?
1. Øget kollisionsfrekvens:
- Hurtigere partikler bevæger sig hurtigere rundt og kolliderer med hinanden oftere.
- Flere kollisioner betyder, at flere chancer for, at de reagerende partikler kommer i kontakt og potentielt reagerer.
2. Højere kollisionsenergi:
- Den kinetiske energi i en partikel er direkte proportional med dens hastighed.
- Hurtigere partikler har mere kinetisk energi, hvilket fører til mere kraftfulde kollisioner.
- Disse kollisioner er mere tilbøjelige til at overvinde aktiveringsenergibarrieren, som er den minimale energi, der kræves for at en reaktion kan forekomme.
3. Større sandsynlighed for vellykkede kollisioner:
- Selv hvis partikler kolliderer, reagerer de ikke altid.
- Succesrige kollisioner kræver, at partiklerne kolliderer med den korrekte orientering og tilstrækkelig energi.
- Hurtigere partikler har en større chance for at opnå den rette orientering og overvinde aktiveringsenergibarrieren under kollision.
Kortfattet:
- hurtigere partikler kolliderer oftere.
- De kolliderer med større energi, hvilket øger sandsynligheden for at overvinde aktiveringsenergien.
- Dette fører til en større sandsynlighed for vellykkede kollisioner og derfor en hurtigere reaktionshastighed.
Vigtig note: Mens øget temperatur fører til hurtigere partikelbevægelse og en hurtigere reaktionshastighed, er det ikke den eneste faktor, der påvirker reaktionshastighederne. Andre faktorer som koncentration, overfladeareal og tilstedeværelsen af katalysatorer spiller også en betydelig rolle.
Sidste artikelHvordan er cirkulær bevægelse accelereret bevægelse?
Næste artikelHvad bidrog Daltons -teorien til videnskab?
 Varme artikler
Varme artikler
-
 Fotoniske krystaller afslører deres indre egenskaber med ny metodeDette billede viser teoretiske (højre) og eksperimentelle (venstre) isofrekvens-konturer af en fotonisk krystalplade overlejret på hinanden. Kredit:Massachusetts Institute of Technology En ny tekn
Fotoniske krystaller afslører deres indre egenskaber med ny metodeDette billede viser teoretiske (højre) og eksperimentelle (venstre) isofrekvens-konturer af en fotonisk krystalplade overlejret på hinanden. Kredit:Massachusetts Institute of Technology En ny tekn -
 Kan mysterierne om antistof og mørkt stof være forbundet?Kredit:CC0 Public Domain Kunne antistof og mørkt stofs dybe mysterier være forbundet? Tænker på, at de måske er, forskere fra det internationale BASE-samarbejde, ledet af Stefan Ulmer fra RIKEN Cl
Kan mysterierne om antistof og mørkt stof være forbundet?Kredit:CC0 Public Domain Kunne antistof og mørkt stofs dybe mysterier være forbundet? Tænker på, at de måske er, forskere fra det internationale BASE-samarbejde, ledet af Stefan Ulmer fra RIKEN Cl -
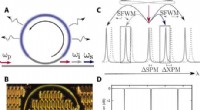 Klemning af lys:Udvikling af en integreret nanofotonisk enhed til at generere klemt lysOversigt over enheden. (A) Skematisk af mikroringenhed, der viser resonator, side kanal, mikrovarmer (blå), og spredningstilstande. (B) Optisk mikroskopbillede af enheden. (C) Illustration af intrares
Klemning af lys:Udvikling af en integreret nanofotonisk enhed til at generere klemt lysOversigt over enheden. (A) Skematisk af mikroringenhed, der viser resonator, side kanal, mikrovarmer (blå), og spredningstilstande. (B) Optisk mikroskopbillede af enheden. (C) Illustration af intrares -
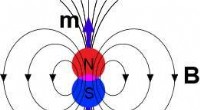 Relativitet betyder noget:To modsatrettede syn på den magnetiske kraft forenesGilbertian - magnetisk dipol. Kredit:en.wikipedia.org/wiki/Magnetic dipole Nuværende lærebøger refererer ofte til Lorentz-Maxwell-kraften styret af den elektriske ladning. Men de henviser sjældent
Relativitet betyder noget:To modsatrettede syn på den magnetiske kraft forenesGilbertian - magnetisk dipol. Kredit:en.wikipedia.org/wiki/Magnetic dipole Nuværende lærebøger refererer ofte til Lorentz-Maxwell-kraften styret af den elektriske ladning. Men de henviser sjældent
- Hvad bruges apparater som i et laboratorium til at måle en lille mængde stoffer, f.eks. 1 ml vand?…
- Hvordan er Surfuce of Moon?
- Hvad er det næste for Large Hadron Collider?
- Hvad er google earth?
- ALMA finder livsingrediens omkring spædbarns sollignende stjerner
- Fysikere med grønne fingre vurderer træspændingshastighed i tilfældige netværk


