Et dødskys for at bedøve de undrugbare
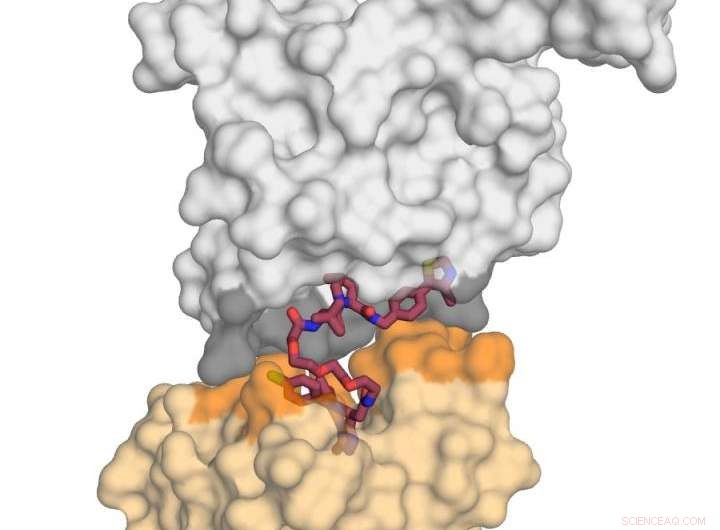
Billedet viser E3 -ligaseproteinet VHL (i gråt) i kompleks med det lille molekyle MZ1 (i hindbær) og 'kysser' proteinet BRD4 (i gult). Efter at have modtaget dette dødelige 'kys', BRD4 er målrettet mod nedbrydning. Kredit:Xavier Lucas, Alessio Ciulli, University of Dundee
Forskere ved University of Dundee har rapporteret et stort gennembrud med at målrette årsagerne til mange sygdomme, ved hjælp af et 'dødskys' til at ødelægge proteiner, der tidligere var blevet betragtet som 'uopnåelige'.
Meget er kendt om proteiner som Ras og Myc, som vides at være skyld i kræft hos mennesker, og Huntingtin, som forårsager Huntingdons sygdom, men endnu har de vist sig stædigt modstandsdygtige over for bestræbelser på at finde måder at tackle dem på med stoffer.
Nu har forskere ledet af professor Alessio Ciulli på School of Life Sciences i Dundee fundet en måde at målrette mod lignende proteiner, ved hjælp af et lille molekyle tilgang på en ukonventionel måde til at målrette mod "dårlige" proteiner ved at binde dem til neutraliserende midler for at starte en nedbrydningsproces, og derved fjerne dem helt.
"Vi kender til mange proteiner, der er aktive til at forårsage sygdomme, men som vi ikke har været i stand til at blokere for at gå `` useriøse '' eller stoppe dem, når de gør det, "sagde professor Ciulli.
"Det største problem er, at vi ikke har kunnet finde de små molekyler, der med succes kan binde til disse proteiner og samtidig hæmme deres funktion. Det er et meget komplekst område - disse proteiner kan ofte narre regulatorer i cellen og være ekstremt svært at fastslå med hæmmere.
"Forskning i vores laboratorium i de sidste par år har bidraget til at etablere en anden tilgang, en, der er blevet teoretiseret i mange år, men som først nu er fuldt ud realiseret ved dette seneste arbejde. I stedet for at bruge det lille molekyle til at prøve at deaktivere det dårlige protein, vi har udviklet en måde at ændre det på, så det kan bruges til at tiltrække de neutraliserende proteiner, som derefter binder sig til deres dårlige nabo og handler imod den, starter en kaskadeproces af nedbrydning.
"Vigtigt, vi har også fundet ud af, at det ikke er nok, at dette neutraliserende protein sidder tæt på det dårlige protein, den skal tage direkte kontakt med den, at 'kysse' det. Og ikke bare et lille pik, men en rigtig 'Gone With The Wind' omfavnelse. Vi kalder dette et 'dødskys', da det er nøglen til at sikre nedbrydning af det dårlige protein. "
Professor Ciulli og kolleger fokuserede deres opmærksomhed på et bivalent kemisk nedbrydende molekyle kaldet 'PROTAC' (Proteolyse-målrettede kimære molekyler). De har været i stand til at skabe den første røntgenkrystalstruktur af en PROTAC bundet til både det 'dårlige' protein og det 'neutraliserende' middel (en E3 ubiquitin ligase), og fandt ud af, at det med succes kan indsættes som en 'magnet' for at trække de to målproteiner sammen.
"Denne opdagelse giver den første nogensinde indsigt i, hvordan PROTAC'er fungerer, og hvordan vi kan målrette proteiner til nedbrydning på en meget selektiv måde, " sagde professor Ciulli.
"Dette præsenterer et paradigmeskifte i, hvordan vi kan sikre selektiv kemisk intervention mod proteiner, som vi ved er faktorer til at forårsage sygdom, men som indtil nu har været umulige at målrette med succes. Det peger mod muligheden for at lægge det" utilrugbare "i fare."
Resultaterne af forskningen offentliggøres i tidsskriftet Naturens kemiske biologi .
Arbejdet udført af Dundee -teamet fokuserede på at parre et af BET -bromodomainproteinerne, BRD4, som er et attraktivt lægemiddelmål for kræft, med en selektiv BRD4 'degrader' kaldet MZ1. De fandt ud af, at MZ1 kunne trække de to proteiner sammen ved at folde sig ind i sig selv. Når de to proteiner er forbundet i deres `` kys '', fører interaktionerne mellem dem til nedbrydning af målet. De viste, hvordan lignende proteiner BRD2 og BRD3 ikke også kysser det neutraliserende protein, og guidet af disse oplysninger var de i stand til at designe nye nedbrydere, der skåner disse proteiner fuldstændigt fra nedbrydningsprocessen. Dette er vigtigt, fordi det belyser, hvordan nedværdigende molekyler kan designes i fremtiden for at minimere off-target effekter på måder, der muligvis ikke er mulige ved hjælp af konventionelle inhibitorer.
Dundee -teamet, der arbejdede på projektet, omfattede postdoktorale forskere i professor Ciullis laboratorium Morgan Gadd, Andrea Testa, Xavier Lucas og Kwok-Ho Chan, og Wengzhan Chan og Dougie Lamont fra Dundee Fingerprints Proteomics Facility.
Professor Ciulli sagde, at der allerede var lovende tegn fra den farmaceutiske industri på betydelige investeringer i dette forskningsområde.
"Vi forstår nu bedre, hvordan man forvandler inhibitorer til nedbrydere. Vejen til at gøre nedbrydere til lægemidler vil være lang og snoet, og vi kan ikke nå dertil på egen hånd. Det er spændende at se tegn på seriøst engagement fra medicinalindustrien, hvilket tilføjer til optimisme, at vi vil være i stand til at komme til et punkt, hvor vi kan lægemiddellægge det 'utilbørlige'. "
 Varme artikler
Varme artikler
-
 Et nyt neuralt netværk til at forstå symmetri, fremskynde materialeforskningLavdimensionel ensartet manifold tilnærmelsesprojektion for at visualisere, hvordan neurale netværk lærer semantisk lighed mellem naturlige billeder. Kredit:Joshua Agar/Lehigh University At forstå
Et nyt neuralt netværk til at forstå symmetri, fremskynde materialeforskningLavdimensionel ensartet manifold tilnærmelsesprojektion for at visualisere, hvordan neurale netværk lærer semantisk lighed mellem naturlige billeder. Kredit:Joshua Agar/Lehigh University At forstå -
 Overfladevidenskabelige begreber er til revisionVæskedråber optager et begrænset sted på den mikroteksturerede overflade, i overensstemmelse med alfobicitet. Imidlertid, ved fordybelse, væsken kan få adgang til hele overfladen fra siderne og ved lo
Overfladevidenskabelige begreber er til revisionVæskedråber optager et begrænset sted på den mikroteksturerede overflade, i overensstemmelse med alfobicitet. Imidlertid, ved fordybelse, væsken kan få adgang til hele overfladen fra siderne og ved lo -
 Lad det regne! Nye belægninger gør naturlige stoffer vandtætteAfvisning af forskellige væsker på polyesterstof belagt med H1F7Ma-co-DVB:sojasovs (sort dråbe), kaffe (brun dråbe), HCl -syre (øverste venstre gennemsigtige dråbe), NaOH (gennemsigtig dråbe nederst t
Lad det regne! Nye belægninger gør naturlige stoffer vandtætteAfvisning af forskellige væsker på polyesterstof belagt med H1F7Ma-co-DVB:sojasovs (sort dråbe), kaffe (brun dråbe), HCl -syre (øverste venstre gennemsigtige dråbe), NaOH (gennemsigtig dråbe nederst t -
 Undersøgelse viser, at keramik kan deformere som metaller, hvis det sintres under et elektrisk feltPurdue-forskere observerede for første gang, hvordan keramik dannet under et elektrisk felt overraskende ændrer form i stedet for at gå i stykker, når det komprimeres ved høj belastning. På billedet:U
Undersøgelse viser, at keramik kan deformere som metaller, hvis det sintres under et elektrisk feltPurdue-forskere observerede for første gang, hvordan keramik dannet under et elektrisk felt overraskende ændrer form i stedet for at gå i stykker, når det komprimeres ved høj belastning. På billedet:U
- Kim Dotcom kæmper mod amerikansk udlevering i New Zealands højesteret
- Sådan fungerer raketmotorer
- Liste over Positive & Negative Ions
- Vejret under tragedie af bjergløb blev forudsagt, men dens virkning var det ikke
- Klimadrevet megatørke opstår i det vestlige USA, siger undersøgelse
- Undersøgelse afslører, hvordan sårfremkaldende bakterier overlever i maven


