Forskere får gennembrud i antioxidantenzym forbundet med gulsot
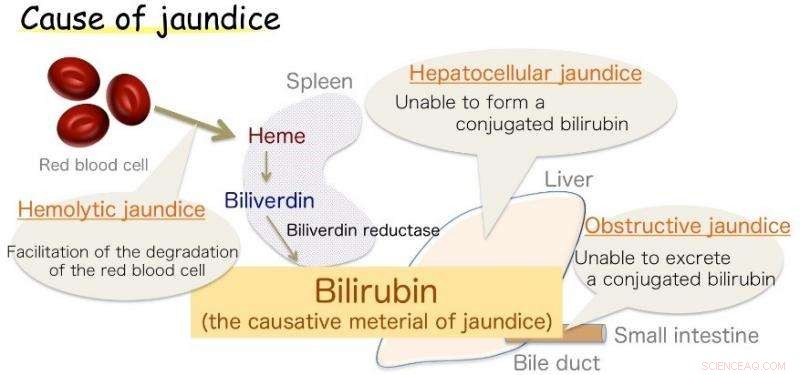
Fig.1:Årsag til gulsot. Bilirubin er det forårsagende materiale til gulsot. Kredit:Osaka University
Et japansk forskerhold involveret Osaka University undersøgte biliverdin reduktase, enzymet, der producerer bilirubin - et stof forbundet med gulsot - fra biliverdin (BV). To BV -molekyler blev fundet på enzymreaktionsstedet, i et usædvanligt stablet arrangement. Mutationsforsøg bekræftede, hvilket enzym aminosyre var nødvendigt for bilirubinproduktion. I den foreslåede mekanisme, denne aminosyre overfører hydrogen til et BV -molekyle, ved hjælp af den anden BV som en kanal. Dette hjælper med at søge efter medicin mod gulsot.
Osaka - gulsot, markeret med gulfarvning af huden, er almindelig hos spædbørn, men også et symptom på forskellige voksne sygdomme. Denne misfarvning skyldes overskydende bilirubin (BR), det stof, der giver galden sit gule skær. Imidlertid, BR er også en vital antioxidant, som på sunde niveauer beskytter celler mod peroxidskader. Dens produktion i kroppen, selvom, har længe været en kilde til usikkerhed.
Nu, et japansk forskningssamarbejde, der involverer Osaka University, mener, at det har svaret. BR vides allerede at være fremstillet af et beslægtet kemikalie, biliverdin (BV), af enzymet biliverdin reduktase (BVR). Enzymet ombrydes omkring BV og overfører to hydrogenatomer - et positivt og et negativt - for at producere den gule antioxidant. Imidlertid, biologer kunne ikke fastslå, hvilken del af enzymet der var kemisk involveret i processen (det aktive sted), eller hvor det positive brint kom fra. Resultaterne blev for nylig rapporteret i Naturkommunikation .
"Tidligere undersøgelser brugte BVR fra rotter, og kunne aldrig krystallisere enzymet godt nok til at bestemme, hvordan det binder sig til BV, "siger medforfatter af undersøgelsen Keiichi Fukuyama." Vi indså, at det samme enzym i Synechocystis-bakterier havde en næsten identisk foldform, men var lettere at undersøge ved røntgenkrystallografi. "
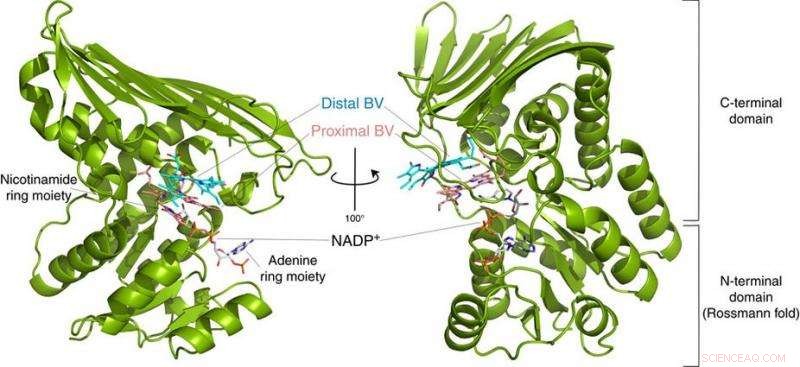
Fig.2:Struktur af BVR. Denne struktur afslørede, at BVR binder to biliverdinsubstrater (Distal BV og Proximal BV) på samme tid. Kredit:Osaka University
Til deres overraskelse, forskerne fandt to molekyler BV - et stablet på det andet - på det aktive sted, selvom kun en er konverteret til BR. Fra røntgendata, de udlede, hvorfor to var nødvendige. Den første BV, på grund af den retning, den vender mod at modtage det negative brint, kan ikke acceptere det positive brint direkte fra enzymet. I stedet, den anden BV fungerer som en hydrogenledning for at muliggøre processen, men er ikke selv konverteret til BR.
Fra strukturen, forskerne foreslog, hvilken af enzymets 328 aminosyrer, der rent faktisk giver det positive hydrogenatom. Derefter, de udførte eksperimenter, hvor enzymerne blev muteret for specifikt at fjerne den aminosyre, mens de andre efterlades intakte. De resulterende enzymer, om det er fra bakterier, rotter, eller mennesker, var stort set ude af stand til at producere BR. Yderligere forsøg bekræftede, at rotte- og humane enzymer også brugte to BV -molekyler, ligesom bakterierne.
"Sådan pæn stabling af to substratmolekyler under enzymatiske processer er meget sjælden, "Fukuyama siger." En bedre forståelse af BR -produktion er ikke bare spændende for biokemi, men skulle hjælpe os med at udvikle lægemidler mod sygdomme præget af alvorlig gulsot fra overskydende BR, såsom hepatitis. "
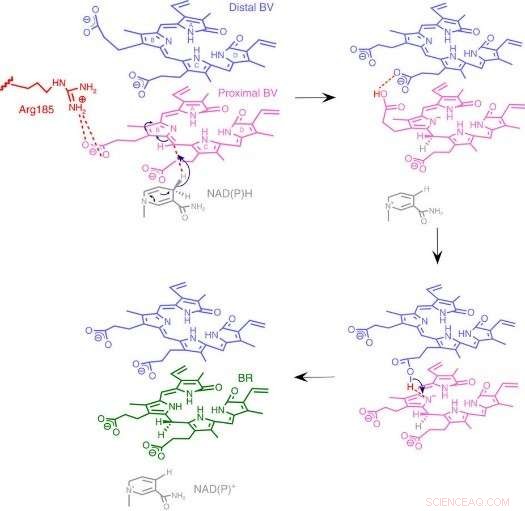
Fig.3:Mekanisme for BVR -reaktionen. Vi foreslår en unik reaktionsmekanisme baseret på en ny enzymstruktur, hvor to stablede substrater bindes til en katalytisk lomme. Kredit:Osaka University
 Varme artikler
Varme artikler
-
 Undersøgelse viser, at fedt brændstof er nødvendigt for at vende hjertehypertrofiForskere ved Purdue University arbejder på at lære mere om forstørrelse af hjertet forårsaget af forhøjet blodtryk, diabetes, og fedme. Disse tværsnitsbilleder af et musehjerte viser den hurtige forst
Undersøgelse viser, at fedt brændstof er nødvendigt for at vende hjertehypertrofiForskere ved Purdue University arbejder på at lære mere om forstørrelse af hjertet forårsaget af forhøjet blodtryk, diabetes, og fedme. Disse tværsnitsbilleder af et musehjerte viser den hurtige forst -
 En hydrogel, der klæber godt til brusk og meniskKredit:Ecole Polytechnique Federale de Lausanne EPFL-forskere har udviklet en hydrogel – bestående af næsten 90 % vand – som naturligt klæber til blødt væv som brusk og menisken. Hvis hydrogelen b
En hydrogel, der klæber godt til brusk og meniskKredit:Ecole Polytechnique Federale de Lausanne EPFL-forskere har udviklet en hydrogel – bestående af næsten 90 % vand – som naturligt klæber til blødt væv som brusk og menisken. Hvis hydrogelen b -
 Video:Hvad gør tardigrader til så store overlevendeKredit:The American Chemical Society Tardigrader er bittesmå dyr, der kan leve i vanddråber stort set overalt. Når disse vanddråber tørrer ud, tardigrader gennemgår en forbløffende transformation
Video:Hvad gør tardigrader til så store overlevendeKredit:The American Chemical Society Tardigrader er bittesmå dyr, der kan leve i vanddråber stort set overalt. Når disse vanddråber tørrer ud, tardigrader gennemgår en forbløffende transformation -
 Ny type indendørs solceller til smarte tilsluttede enhederKredit:Uppsala Universitet I en fremtid, hvor det meste i vores hverdag er forbundet via internettet, enheder og sensorer skal køre uden ledninger eller batterier. I en ny artikel i Kemisk Videns
Ny type indendørs solceller til smarte tilsluttede enhederKredit:Uppsala Universitet I en fremtid, hvor det meste i vores hverdag er forbundet via internettet, enheder og sensorer skal køre uden ledninger eller batterier. I en ny artikel i Kemisk Videns
- Sådan beregnes solution Potential
- Fysikere skubber til atomer inden for mindre end en billiontedel af et sekund
- Virksomheder, der overtræder ikke-regnskabsmæssige værdipapirlove, er mere tilbøjelige til at ov…
- Musik er afgørende for overførsel af etnobiologisk viden
- Hydraulisk frakturering, der sjældent er forbundet med følt seismisk rystelse:undersøgelse
- Opstår tornadoer kun i Nordamerika?


