Mod en bedre forståelse af struktur-metabolisme-forhold i human aldehydoxidase (opdatering)
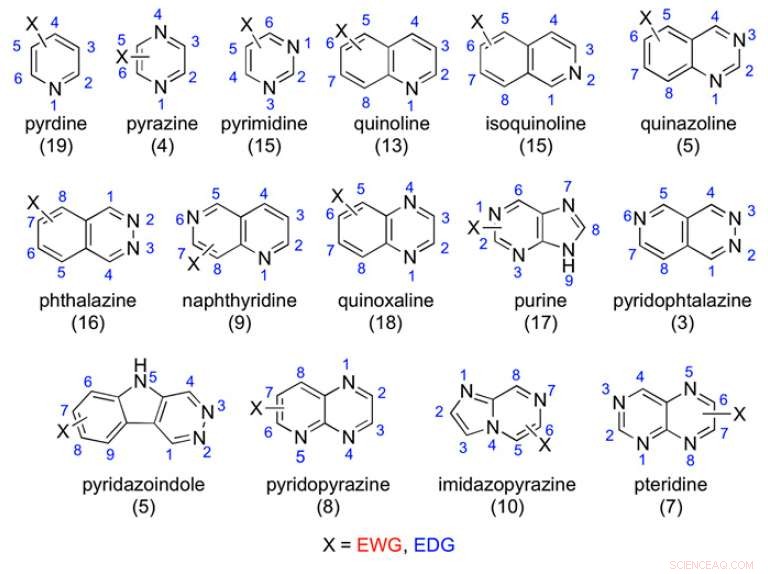
Eksempler på de undersøgte azaaromatiske stilladser:antallet af testede forbindelser er angivet i parentes. Kredit:(c) Procedurer fra National Academy of Sciences (2017). DOI:10.1073/pnas.1618881114
(Phys.org)-Lægemiddeldesign involverer guidet forsøg og fejl. Hvordan kroppen metaboliserer et bestemt lægemiddel er vigtigt for at bestemme lægemidlets effektivitet. Der har været mange undersøgelser for at forstå, hvordan xenobiotika interagerer med cytokrom P450'er, en vigtig klasse af enzymer i lægemiddelmetabolisme, men der er gjort lidt forskning for at forstå aldehydoxidase (AOX) metabolisme. AOX, placeret i leveren, spiller en vigtig rolle i stofskiftet; imidlertid, mange potentielle lægemidler ender med at mislykkes under sene forsøg på grund af deres interaktion med AOX.
For bedre at forstå struktur-metabolisme-forholdet mellem funktionelle grupper og AOX samt at etablere generelle retningslinjer for ikke-cytokrom P450 lægemiddelmetabolisme, forskere fra University of Perguia i Italien gennemførte test på 198 forbindelser med azaaromatiske stilladser for at se, hvilke der blev oxideret af AOX. Desuden, de testede 75 amid -stilladser for at bestemme, hvilke der blev hydrolyseret. De fandt ud af, at elektroniske faktorer såvel som sterisk hindring påvirkede molekylets orientering på MoCo -aktive sted, som afgjorde, om forbindelsen blev metaboliseret af AOX. Deres arbejde vises i Procedurer fra National Academy of Sciences .
AOX er et enzym i leveren, der har en tendens til at oxidere aza-aromatiske forbindelser som en fase I-metabolit. Undersøgelser har vist, at AOX aktiverer det usubstituerede carbon ortho til nitrogenet på aza heterocyklussen. Fordi dette er det mest elektropositive carbon i den aromatiske ring, elektrontæthed spiller sandsynligvis en rolle i AOX -aktivering. Men disse undersøgelser, såvel som andre, der ser på AOX -stofskifte, var baseret på et lille antal molekyler, der ikke giver mulighed for at udlede et generelt mønster for struktur-metabolisme forhold.
I den aktuelle undersøgelse, Lepri et al. testet 198 azaaromatiske forbindelser for at se, om de blev oxideret af AOX. Hver af disse havde typiske aza-aromatiske stilladser med variationer på elektronudtagning og elektrondonerende substituenter. De har enten erhvervet eller lavet dette katalog af forbindelser og derefter udført in vitro metabolismeundersøgelser ved hjælp af humant levercytosol.
DFT -beregninger blev brugt til at belyse virkningerne af elektrontæthed for AOX -aktivitet. Metabolitetsstedet på den aromatiske forbindelse havde en tendens til at svare til det mest elektro-positive usubstituerede carbon, som forventet. Derudover beregningsundersøgelser blev brugt til at udføre docking -analyse af forbindelserne på det aktive sted i AOX.
Forfatterne fandt nogle tendenser til stedet for metabolisme; imidlertid, disse tendenser kompliceres af flere faktorer. Pyridinstilladset var det eneste, der, som stillads klasse, var ikke modtagelig for AOX -metabolisme. De andre grupper var stærkt afhængige af elektrontætheden på bestemte carbonatomer eller, som forfatterne fandt med forbindelser såsom quinoxaliner og visse bicykliske forbindelser, sterisk hindring på det aktive sted forhindrede AOX -metabolisme.
Lepri et al. testede også 73 amidforbindelser for at se, om AOX hydrolyserede amidbindingen. Generelt, hvis der var en elektron -tilbagetrækningsgruppe i orthopositionen på analinet, så oxiderede AOX det ikke. Hvis der var en elektrondonerende gruppe, så gjorde det. Meta- og para -versionerne af elektrondonerende og elektronoptagende grupper var ikke modtagelige for AOX -metabolisme.
Eksponeringseffekter var en vigtig komponent for, om en forbindelse blev metaboliseret af AOX. Dette har at gøre med molekylets orientering mod MoCo -centret på det aktive sted i AOX. Visse omfangsrige grupper resulterede i ingen aktivitet, hvor man forventedes baseret på beregningsundersøgelser. Derudover hydrofobicitet påvirkede også, hvordan forbindelsen interagerede med det aktive sted. Når det reaktive kulstof udsættes for MoCo -centeret, derefter metaboliseres forbindelsen let. Men, når den ureaktive del af forbindelsen er orienteret mod MoCo -centeret, så er forbindelsen mindre tilbøjelig til at blive oxideret eller hydrolyseret.
Forfatterne påpeger, at fra disse forsøg "fremgår det, at det slet ikke er let at forudsige, om en forbindelse er et substrat for AOX eller ej." Vanskeligheden ligger i at forstå reaktiviteten af det elektrofile carbon på forbindelsen samt hvordan den pågældende forbindelse vil orientere sig i enzymets aktive sted. Imidlertid, denne undersøgelse giver et udgangspunkt for yderligere undersøgelser og mere sofistikerede modelleringsteknikker.
© 2017 Phys.org
 Varme artikler
Varme artikler
-
 Sniff-cam for at opdage sygdomKredit:American Chemical Society At have dårlig ånde kan betyde, at nogen spiste en ildelugtende frokost, men det kan indikere, at personen er syg. Forskellige duftforbindelser er blevet forbundet
Sniff-cam for at opdage sygdomKredit:American Chemical Society At have dårlig ånde kan betyde, at nogen spiste en ildelugtende frokost, men det kan indikere, at personen er syg. Forskellige duftforbindelser er blevet forbundet -
 Ny strategi designet til bæredygtig produktion af benzylaminer fra ligninBæredygtig produktion af benzylaminer fra lignin. Kredit:LI Changzhi Benzylaminer, en type N-funktionaliserede aromater, anvendes i vid udstrækning som forløbere for lægemidler og syntetiske farve
Ny strategi designet til bæredygtig produktion af benzylaminer fra ligninBæredygtig produktion af benzylaminer fra lignin. Kredit:LI Changzhi Benzylaminer, en type N-funktionaliserede aromater, anvendes i vid udstrækning som forløbere for lægemidler og syntetiske farve -
 En kemisk kappe af usynlighed kan afsløre RNAs hemmelighederEn hårnålesløjfe fra et præ-mRNA. Fremhævet er nukleobaserne (grønne) og ribose-phosphat-rygraden (blå). Bemærk, at dette er en enkelt streng af RNA, der foldes tilbage på sig selv. Kredit:Vossman/ Wi
En kemisk kappe af usynlighed kan afsløre RNAs hemmelighederEn hårnålesløjfe fra et præ-mRNA. Fremhævet er nukleobaserne (grønne) og ribose-phosphat-rygraden (blå). Bemærk, at dette er en enkelt streng af RNA, der foldes tilbage på sig selv. Kredit:Vossman/ Wi -
 Samlingsteori kan betyde gode nyheder for lægemiddelopdagelseFig. 1. Repræsentationer af en samlingsvej, ved at tage adenin som eksempel. (A) En af adenins mange samlingsveje (det viser sig at være den korteste, ifølge vores MC-algoritme, forklaret senere). Sam
Samlingsteori kan betyde gode nyheder for lægemiddelopdagelseFig. 1. Repræsentationer af en samlingsvej, ved at tage adenin som eksempel. (A) En af adenins mange samlingsveje (det viser sig at være den korteste, ifølge vores MC-algoritme, forklaret senere). Sam
- Mindre kød, flere fejl i vores kostfremtid, forskere insisterer stadig
- 3-D grafen har løftet for bioapplikationer:Team svejser plader i nanoskala for at danne hårde, por…
- Typer af uldne larver
- Mekanismen for gammastråleudbrud fra rummet afkodes
- Qatar underskriver 470 millioner dollars solenergiaftale
- Hvad er objektivlinsens funktioner?


