Indsigt i enzymers 3D-struktur kan reducere omkostningerne til biobrændstof
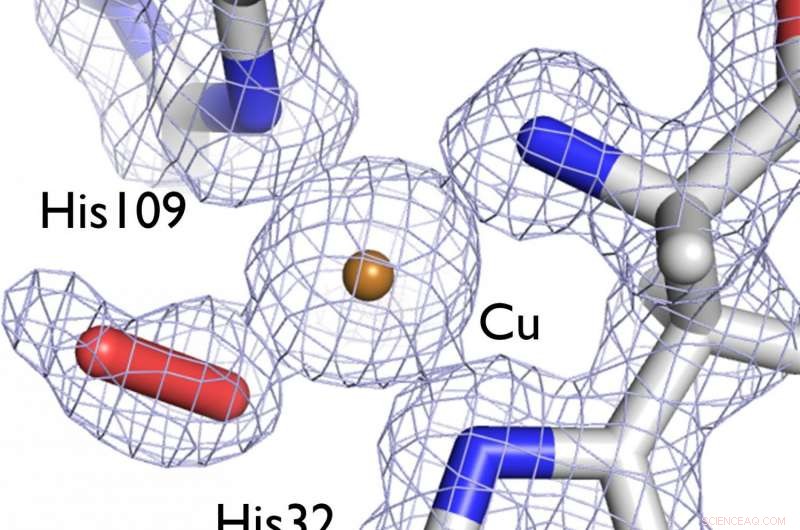
At forstå strukturen af et enzym, der hjælper bakterier med at nedbryde cellulose og kitin i træagtige plantefibre, kan hjælpe med at udvikle bedre biobrændstoffer. På dette billede, et elektrontæthedskort (grå) viser strukturen af det aktive steds centrum af LPMO-enzymet under undersøgelse, skildrer et dioxygenmolekyle (rød stav) bundet til en katalytisk kobberion (bronze). Kredit:LANL
Ved hjælp af neutronkrystallografi, et Los Alamos-forskerhold har kortlagt den tredimensionelle struktur af et protein, der nedbryder polysaccharider, såsom den fibrøse cellulose fra græsser og træagtige planter, et fund, der kunne hjælpe med at nedbringe omkostningerne ved at skabe biobrændstoffer. Forskningen fokuserede på en klasse af kobberafhængige enzymer kaldet lytiske polysaccharidmonooxygenaser (LPMO'er), som bakterier og svampe bruger til naturligt at nedbryde cellulose og nært beslægtede kitinbiopolymerer.
"På lang sigt, forståelse af mekanismen for denne klasse af proteiner kan føre til enzymer med forbedrede egenskaber, der gør produktion af ethanol i stigende grad økonomisk gennemførlig, " sagde Julian Chen, en Los Alamos National Laboratory-forsker, der deltog i forskningen.
Et multiinstitutionsteam brugte neutronspredningsanlægget ved Spallation Neutron Source (SNS) ved Oak Ridge National Laboratory og Advanced Light Source (ALS) synkrotronrøntgenkilden på Lawrence Berkeley National Laboratory til at studere LPMO. Både SNS og ALS er DOE Office of Science User Facilities.
Los Alamos Bioscience Divisions forskere Chen, Clifford Unkefer, og tidligere postdoktor John Bacik, arbejder med samarbejdspartnere på Oak Ridge National Laboratory, Lawrence Berkeley Laboratory, og Norges Biovidenskabelige Universitet, løst strukturen af en kitin-nedbrydende LPMO fra bakterien Jonesia denitrificans (JdLPMO10A). Holdets resultater offentliggøres i tidsskriftet Biokemi .
En af de største udfordringer, biobrændstofforskere står over for, er at finde omkostningseffektive måder at adskille polysaccharider som stivelse og cellulose, som er vidt udbredt i planter, ind i deres underkomponent sukker til produktion af biobrændstoffer. LPMO enzymer, som ses som nøglen til denne proces, bruge en enkelt kobberion til at aktivere oxygen, et kritisk trin for enzymets katalytiske nedbrydende virkning.
Mens den specifikke mekanisme for LPMO-virkning forbliver usikker, det menes, at katalyse involverer initial dannelse af et superoxid ved elektronoverførsel fra den reducerede kobberion. Ved at forstå placeringen af kobberionen og konstellationen af atomer i nærheden af den, forskerne håber at kunne belyse mere om enzymets funktion. At gøre dette, de er afhængige af først at bestemme enzymets struktur.
Selvom en række røntgenkrystallografiske strukturer i øjeblikket er tilgængelige for LPMO'er fra svampe- og bakteriearter, denne nye struktur er mere komplet. Efterforskerne brugte røntgenkrystallografi til at opløse den tredimensionelle struktur i klare detaljer af alle atomerne undtagen hydrogener, de mindste og mest rigelige atomer i proteiner. Hydrogenatompositioner er vigtige for at belyse funktionelle karakteristika af målproteinet og kan bedst visualiseres ved hjælp af en neutronkrystallografi. Efterforskerne brugte denne komplementære teknik, at bestemme den tredimensionelle struktur af LPMO, men fremhæver brintatomerne.
Især i denne undersøgelse er det krystalliserede LPMO-enzym blevet fanget i færd med at binde oxygen. Sammen med de seneste strukturer af LPMO'er fra en bred vifte af svampe- og bakteriearter, resultaterne af denne undersøgelse indikerer en fælles mekanisme til nedbrydning af cellulosebiomasse på trods af store forskelle i deres proteinsekvenser. Denne undersøgelse har fremmet indsigt i virkningsmekanismen for LPMO'er, især kobberionens rolle og arten af involveringen af oxygen.
Forskning i biobrændstoffer er en del af Los Alamos National Laboratorys missionsfokus på at integrere forsknings- og udviklingsløsninger for at opnå den maksimale indvirkning på strategiske nationale sikkerhedsprioriteter såsom nye energikilder.
 Varme artikler
Varme artikler
-
 Hvordan metaller arbejder sammen for at svække hårdføre nitrogen-nitrogen-bindingerKredit:CC0 Public Domain nitrogen, et element, der er essentielt for alle levende celler, udgør omkring 78 procent af Jordens atmosfære. Imidlertid, de fleste organismer kan ikke gøre brug af dett
Hvordan metaller arbejder sammen for at svække hårdføre nitrogen-nitrogen-bindingerKredit:CC0 Public Domain nitrogen, et element, der er essentielt for alle levende celler, udgør omkring 78 procent af Jordens atmosfære. Imidlertid, de fleste organismer kan ikke gøre brug af dett -
 Ny genanvendelig hydrogel kunne høste rent, afsaltet vand fra fugtig luft over havoverfladerDen nye hydrogel udviklet af et team fra National University of Singapore, ledet af adjunkt Tan Swee Ching (yderst til højre), kan bruges til at høste rent vand fra fugtig luft over havoverflader, blo
Ny genanvendelig hydrogel kunne høste rent, afsaltet vand fra fugtig luft over havoverfladerDen nye hydrogel udviklet af et team fra National University of Singapore, ledet af adjunkt Tan Swee Ching (yderst til højre), kan bruges til at høste rent vand fra fugtig luft over havoverflader, blo -
 Kræft målrettet med genanvendelig brændenældebehandlingRepræsentation af den organiske osmiumforbindelse, som udløses ved hjælp af en ikke-toksisk dosis natriumformiat, et naturligt produkt, der findes i mange organismer, herunder brændenælder og myrer. K
Kræft målrettet med genanvendelig brændenældebehandlingRepræsentation af den organiske osmiumforbindelse, som udløses ved hjælp af en ikke-toksisk dosis natriumformiat, et naturligt produkt, der findes i mange organismer, herunder brændenælder og myrer. K -
 Nanoteknologi gør det muligt for ingeniører at svejse tidligere usvejsbare aluminiumslegeringerTo stykker aluminiumslegering 7075 svejset sammen ved hjælp af en nanopartikel-forstærket fyldtråd. Kredit:Oszie Tarula/UCLA En aluminiumslegering udviklet i 1940erne har længe holdt et løfte til
Nanoteknologi gør det muligt for ingeniører at svejse tidligere usvejsbare aluminiumslegeringerTo stykker aluminiumslegering 7075 svejset sammen ved hjælp af en nanopartikel-forstærket fyldtråd. Kredit:Oszie Tarula/UCLA En aluminiumslegering udviklet i 1940erne har længe holdt et løfte til
- Rack-and-Pinion: Gear Ratio
- Forskere tager celler fra chrysalis og bruger dem til at dyrke sommerfuglvinger i laboratoriet
- Er sølv nanopartikler en sølvkugle mod mikrober?
- Valgsikkerhed betyder meget mere end blot nye stemmemaskiner
- Forskere finder en måde at skrælle slimede biofilm som gamle klistermærker
- Overfladefugtelighed har ringe effekt på atmosfærisk vandopsamling, men kantstrukturen er afgøren…


