Detaljeret visning af en molekylær toksintransporter
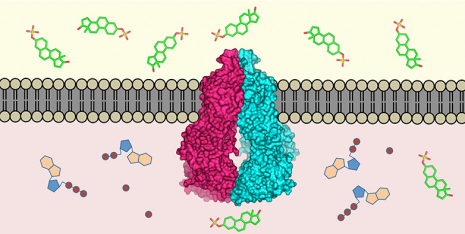
Transportproteinet ABCG2 (midten) er indlejret i cellemembranen. Den genkender over 200 stoffer i cellens indre (nedenfor) og transporterer dem udenfor (ovenfor). Kredit:ETH Zürich / Scott Jackson, Ioannis Manolaridis, Kaspar Locher
Transportproteiner i cellerne i vores krop beskytter os mod bestemte toksiner. Forskere ved ETH Zürich og Universitetet i Basel har nu bestemt den højopløselige tredimensionelle struktur af et stort humant transportprotein. På lang sigt, dette kan være med til at udvikle ny medicin.
Næsten alle levende væsner har udviklet mekanismer til at fjerne toksiner, der er trængt ind i deres celler:molekylære pumper placeret i cellemembranen genkender skadelige stoffer i cellens indre og transporterer dem udenfor. Forskere fra ETH Zürich og Biozentrum ved universitetet i Basel har nu defineret den tredimensionelle struktur af et sådant transportprotein hos mennesker (proteinet ABCG2) på atomniveau. Det er første gang, en sådan struktur er blevet defineret for en human multi-drug transporter. Forskerne offentliggjorde deres arbejde i det seneste nummer af det videnskabelige tidsskrift Natur .
"Proteinet ABCG2 genkender og transporterer mindst 200 kendte stoffer, " forklarer Kaspar Locher, Professor i molekylær membranbiologi ved ETH Zürich og leder af undersøgelsen. Disse stoffer omfatter alkaloider – plantestoffer, som vi indtager sammen med vores mad – men også stoffer produceret af kroppen selv, såsom urinsyre eller bilirubin (en metabolit af hæmoglobin).
Proteinet er aktivt i tarmvæggen, for eksempel, hvor det forhindrer skadelige stoffer i at trænge ind i blodet; det findes også i cellerne i blod-hjerne-barrieren, hvor det holder toksiner væk fra hjernen. Proteiner som ABCG2 spiller også en vigtig rolle i mælkekirtlerne og i moderkagen, hvor de sikrer, at der ikke kommer giftstoffer i modermælken eller blodbanen hos et ufødt barn.
Tveægget sværd
Rollen som multi-drug transportører har en ulempe, dog:proteinerne pumper også noget medicin ud af cellerne, forhindrer dem i at virke i disse celler. "Det betyder, at når man udvikler medicin, det er altid vigtigt at undersøge, om de genkendes af transportproteiner såsom ABCG2, " siger Locher. Medicin givet oralt skal trænge ind i tarmvæggen, og dem, der er beregnet til hjernen, skal passere blod-hjerne-barrieren – hvilket de kun kan gøre, hvis ABCG2 ikke genkender dem.
Det er velkendt, imidlertid, at ABCG2 genkender nogle kræftlægemidler (kemoterapeutika). Dette er særligt alvorligt, fordi visse tumorceller er i stand til at øge antallet af ABCG2-proteiner i deres cellemembraner. Sådanne celler pumper effektivt det kemoterapeutiske stof udad - hvilket betyder, at de er resistente over for lægemidlet.
Udvikling af lægemidler med computere
Nu hvor forskerne kender strukturen af ABCG2, i fremtiden kan de muligvis simulere på en computer, om nye lægemidler vil blive genkendt af transportproteinet. Forskere kunne også bruge computermodellering til at udvikle bedre antistoffer til diagnosticering af lægemiddelresistente kræftceller, eller lægemidler, der hæmmer transportproteinet. Sådanne stoffer kunne hjælpe med at overvinde resistens over for bestemte kemoterapeutika. "Bidragene fra vores forskning til medicin, især kræftmedicin, skal virkelig ses på længere sigt. Vi bygger primært fundamentet, " understreger Locher.
ABCG2 er et meget mobilt molekyle, hvilket gjorde det vanskeligt at bestemme dens atomare struktur. Ved at bruge stabiliserende antistoffer, imidlertid, det lykkedes forskerne at immobilisere proteinet. Den tredimensionelle struktur blev bestemt ved hjælp af kryo-elektronmikroskopi af ETH-forskerne i samarbejde med Henning Stahlberg, en professor ved Biozentrum ved Universitetet i Basel, og hans gruppe. "Vi har for nylig arbejdet intensivt på at optimere opløsningskapaciteten af vores elektronmikroskoper, og i det væsentlige automatisere dem på samme tid. Dette har nu resulteret i en utrolig hurtig strukturbestemmelsespipeline, siger Stahlberg.
Kryo-elektronmikroskopi er en forholdsvis ny teknologi til bestemmelse af atomare molekylære strukturer. "Denne teknologi har udløst en revolution inden for strukturel biologi, " siger Locher. I lyset af dens betydning, ETH Zürich vil fortsætte med at investere i metoden og vil erhverve et andet high-end kryo-elektronmikroskop til ScopeM mikroskopicentret. Det vil være tilgængeligt for alle biovidenskabelige forskere at studere molekyler og strukturer med atomopløsning.
 Varme artikler
Varme artikler
-
 Lifes byggesten observeret i rumlignende omgivelserLavenergi-elektronpåvirkning formidler skabelsen af nye komplekse organiske molekyler, såsom ethanol, i astrofysiske/planetariske modelis indeholdende metan og ilt; mens nogle af de nye arter desorb
Lifes byggesten observeret i rumlignende omgivelserLavenergi-elektronpåvirkning formidler skabelsen af nye komplekse organiske molekyler, såsom ethanol, i astrofysiske/planetariske modelis indeholdende metan og ilt; mens nogle af de nye arter desorb -
 Ny metode til varmeledning kunne være en game changer for serverfarme og flyLaboratoriemedlem Mojtaba Edalatpour viser den termiske diode udviklet af Boreykos team. Kredit:Virginia Tech Jonathan Boreyko, en lektor i maskinteknik, har udviklet en termisk styringsteknologi
Ny metode til varmeledning kunne være en game changer for serverfarme og flyLaboratoriemedlem Mojtaba Edalatpour viser den termiske diode udviklet af Boreykos team. Kredit:Virginia Tech Jonathan Boreyko, en lektor i maskinteknik, har udviklet en termisk styringsteknologi -
 Forskere til at skabe galaktiske byggesten til at studere rummet mellem stjernerForskere planlægger at syntetisere en klasse af kemiske forbindelser for at afgøre, om de er en vigtig byggesten til fremstilling af galakser. Holdet fra Imperial College London har modtaget startfin
Forskere til at skabe galaktiske byggesten til at studere rummet mellem stjernerForskere planlægger at syntetisere en klasse af kemiske forbindelser for at afgøre, om de er en vigtig byggesten til fremstilling af galakser. Holdet fra Imperial College London har modtaget startfin -
 Optimering af en ny sprøjtemetode til keramiske belægningerEn keramisk film fremstillet ved pulveraerosolaflejring på en porøs gasgennemtrængelig elektrode, som dem, der kræves i brændselsceller. Kredit:Jörg Exner. I lang tid, produktionen af keramiske
Optimering af en ny sprøjtemetode til keramiske belægningerEn keramisk film fremstillet ved pulveraerosolaflejring på en porøs gasgennemtrængelig elektrode, som dem, der kræves i brændselsceller. Kredit:Jörg Exner. I lang tid, produktionen af keramiske
- Sjove High School Science eksperimenter
- Som rutinerede ferieentusiaster, majoid krabber pynter deres skaller
- Den amerikanske regerings rapport for at advare om, at klimaændringer er reelle
- Ny metode forbedrer produktionen af biobrint og andre biokemikalier markant
- NASA-mission for at teste teknologi til satellitsværme
- Ekstreme solstorme kan være hyppigere end tidligere antaget


