Kemikere opdagede, hvordan hugormegiften virker
Kredit:Institut for Bioorganisk Kemi ved Det Russiske Videnskabsakademi
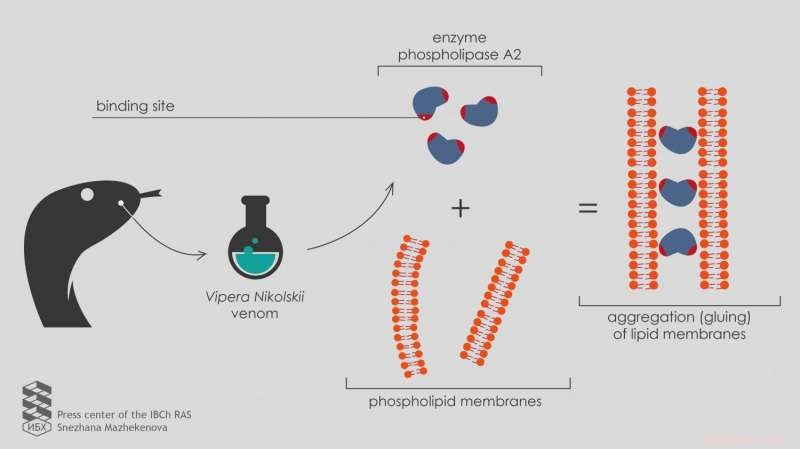
Russiske videnskabsmænd rapporterer, at enzymet phospholipase A2 fra Vipera nikolskii-giften er i stand til at klæbe til lipidmembraner og forårsage deres aggregering, også selvom aktiviteten af enzymet er specifikt blokeret. Dette skyldes tilstedeværelsen af to bindingssteder i enzymstrukturen. Udgivet i tidsskriftet Toksikum , resultaterne hjælper med at forstå, hvordan multikomponent slangegifte virker.
Nogle dyr undgår fare ved hjælp af camouflage, andre med kløer, tænder eller hove. Og nogle insekter, edderkopper, skorpioner og slanger har gifte, der ikke kun kan lamme, men også dræbe angriberen. Mange forskere er interesserede i de komplekse giftkomponenter, fordi de kan bruges til at producere modgift og skabe nye lægemidler. Gifte indeholder neurotoksiner - giftstoffer, der virker på nervesystemet og blokerer ledningen af nerveimpulser. Disse neurotoksiner omfatter visse typer enzym phospholipase A2.
Forskernes interesse for phospholipase A2 skyldes, at det fungerer som markør for inflammation. Det betyder, at niveauet af dette enzym i blodet stiger med akut betændelse i kroppen. Derfor, flere internationale videnskabelige grupper forsøger at skabe systemer til påvisning af aktiviteten af phospholipase A2.
I 2016 forskere ved Laboratory of Lipid Chemistry i ICBh RAS har udviklet en fundamentalt ny fluorescensmetode til påvisning af dette enzyms interaktion med et dobbeltmolekylært lag af lipider (det såkaldte lipid-dobbeltlag) - cellemembranens grundstruktur. Metoden er baseret på energioverførsel mellem to fluorescerende farvestoffer (fluoroforer knyttet til phospholipidmolekylerne) indlejret i lipiddobbeltlaget.
"For at teste den nye udvikling på så mange prøver som muligt, vi henvendte os til Laboratory of Molecular Toxinology ICBh RAS, " siger Ivan Boldyrev, en seniorforsker ved Laboratory of Lipid Chemistry. "Laboratoriets leder, Yuri Utkin, har indsamlet et sæt phospholipaser A2 fra giftstoffer fra forskellige organismer, inklusive to heterodimere phospholipaser A2 fra Vipera nikolskii gift. Hvert af disse enzymer består af to heterofunktionelle underenheder, polypeptidkæder foldet på en specifik måde. Imidlertid, den toksiske virkningsmekanisme af disse heterodimerer er ikke klar."
Undersøgelsen gav uventede resultater. Under påvirkning af disse "dobbelte proteiner" (heterodimerer), fluorescens forekom ikke, som med alle andre fosfolipaser, men i stedet forfalden.
En mere dybdegående undersøgelse ved hjælp af elektronmikroskopi viste, at heterodimere phospholipaser A2 fra Vipera nikolskii-giften forårsagede aggregering af lipidmembraner, hvilket betyder, at de limer dem sammen. Imidlertid, denne effekt opstod kun med negativt ladede membraner.
"Uladede membraner uden elektrisk ladning på overfladen kombineres ikke under påvirkning af heterodimerer, " forklarer Anna Alekseeva, en juniorforsker ved Laboratory of Lipid Chemistry.
"Vi formåede at fastslå specificiteten af heterodimere phospholipaser A2 for negativt ladede membraner og bestemte pH-betingelser for mediet, hvor enzymet manifesterer sig, " siger Daria Tretyakova, en ph.d. studerende ved Laboratoriet for Lipidkemi.
De nye data vil hjælpe med at forstå effekten af multikomponent slangegifte, og den udviklede metodik vil være efterspurgt til at studere andre lipid-protein-interaktioner.
 Varme artikler
Varme artikler
-
 EN SKY af muligheder:At finde nye terapier ved at kombinere lægemidlerSkematisk repræsentation af filtrerings- og klyngeproceduren, der fører til 308 CLOUD-lægemidlerne. Kredit:(c) Naturens kemiske biologi / Stefan Kubicek CeMM Library of Unique Drugs (CLOUD) er d
EN SKY af muligheder:At finde nye terapier ved at kombinere lægemidlerSkematisk repræsentation af filtrerings- og klyngeproceduren, der fører til 308 CLOUD-lægemidlerne. Kredit:(c) Naturens kemiske biologi / Stefan Kubicek CeMM Library of Unique Drugs (CLOUD) er d -
 Hvad er forskellen mellem et monosaccharid og et disaccharid?Monosaccharider og disaccharider udgør de mindste typer kulhydrater. Generelt udviser de meget af de samme egenskaber; såsom vandopløselighed og en sød smag. Begge består kun af kulstof, brint og ilt
Hvad er forskellen mellem et monosaccharid og et disaccharid?Monosaccharider og disaccharider udgør de mindste typer kulhydrater. Generelt udviser de meget af de samme egenskaber; såsom vandopløselighed og en sød smag. Begge består kun af kulstof, brint og ilt -
 MR -mærker klæber til molekyler med kemisk velcroI den nye teknik, MR -kemiske mærker knytter sig til et målmolekyle og intet andet - ligesom hvordan velcro kun klæber til sig selv. Kredit:tanakawho, via Flickr Forestil dig at vedhæfte et fyrtår
MR -mærker klæber til molekyler med kemisk velcroI den nye teknik, MR -kemiske mærker knytter sig til et målmolekyle og intet andet - ligesom hvordan velcro kun klæber til sig selv. Kredit:tanakawho, via Flickr Forestil dig at vedhæfte et fyrtår -
 Kemikere udvider den genetiske kode for E. coli til at producere den 21. aminosyre, giver det nye ev…Forskere fra Rice University introducerede ikke -kanoniske aminosyre byggesten i proteiner i levende celler, banebrydende et kraftfuldt værktøj til at undersøge og manipulere proteiners struktur og fu
Kemikere udvider den genetiske kode for E. coli til at producere den 21. aminosyre, giver det nye ev…Forskere fra Rice University introducerede ikke -kanoniske aminosyre byggesten i proteiner i levende celler, banebrydende et kraftfuldt værktøj til at undersøge og manipulere proteiners struktur og fu
- Stanford-studerende implementerer maskinlæring for at hjælpe med miljøovervågning
- Syntetisering af grønne guld nanopartikler til kræftbehandling med biomolekyler
- Den fysiske grænse for kvanteoptik løser et mysterium om beregningskompleksitet
- Startups rystede op på det søvnige barberknivsmarked. Hvad er det næste?
- Ny dual-resonans metode i 2-D materialer kan anspore fremskridt inden for fotonik
- En finkornet udsigt over støvstorme


