Virkninger af et stort lægemiddelmål reguleret gennem molekylære koder
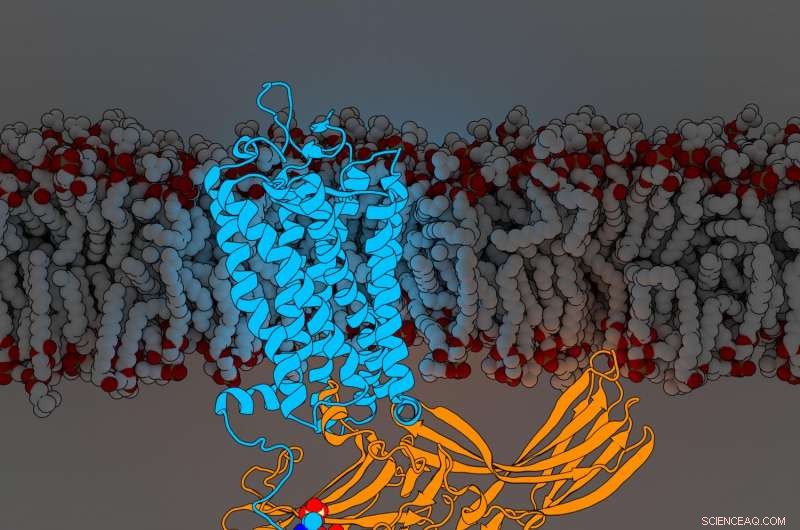
Rhodopsinarrestin. Kredit:Parker de Waal, Xu Laboratory, Van Andel Research Institute
Et hold med Van Andel Research Institute-forskere i spidsen har besvaret et mangeårigt spørgsmål, der kan føre til mere effektive lægemidler med færre bivirkninger til sygdomme lige fra hjertesvigt til kræft.
Fundene, udgivet i dag i Celle , afslører for første gang komponenter i en G-proteinkoblet receptor (GPCR) ved navn rhodopsin bundet til et signalmolekyle kaldet arrestin, begge afgørende dele af kroppens indviklede cellulære kommunikationsnetværk. Den nye opdagelse forfiner et skelsættende 2015 yderligere Natur artikel, der først beskrev strukturen af de to molekyler i kompleks sammen.
"Vores reviderede struktur er som en køreplan med yderligere detaljer og geografiske funktioner udfyldt, "sagde VARI professor H. Eric Xu, Ph.D., hovedforfatteren til den nye undersøgelse samt 2015-artiklen. "Årevis, feltet har søgt at besvare præcis, hvordan arrestiner interagerer med GPCR'er. Vi håber det svar, som vores arbejde giver, i forbindelse med rhodopsin, vil sætte skub i ny forskning og design af bedre medicin, til den ultimative fordel for patienter rundt om i verden. "
GPCR'er er den største gruppe af celleoverfladereceptorer, og fungere som informationsclearinghouse ved at forbinde med enten arrestiner eller andre signalmolekyler kaldet G-proteiner for at videregive kritiske instruktioner til utallige biologiske funktioner, herunder vækst og hormonregulering. Disse egenskaber, kombineret med deres placering på overfladen af cellen, gøre dem til attraktive mål for lægemiddelbehandling. Anslået 30 procent af al medicin, der i øjeblikket er på markedet, er målrettet mod GPCR'er.
"Da arrestiner og G -proteiner medierer forskellige cellulære reaktioner, at udvikle lægemidler, der kun aktiverer én af disse to veje, kan give færre bivirkninger for patienter, sagde Karsten Melcher, Ph.D., seniorforfatter på papiret og lektor ved VARI. "Den indsigt, som vores udvidede struktur giver, kan gå langt i at vejlede designet af disse terapier."
For at bestemme deres udvidede struktur, Xu Lab seniorforsker Edward Zhou, Ph.D., genanalyseret mere end 22, 000 individuelle billeder indsamlet til den originale 2015-undersøgelse ved hjælp af forbedret software, der ikke var tilgængelig på det tidspunkt. Den afslørede tre tidligere skjulte molekylære komponenter kaldet phosphorylgrupper på rhodopsin og tre tilsvarende lommer på arrestin, der fungerer som docking-stationer. Det specifikke arrangement af disse phosphorylgrupper - kendt som phosphoryleringskoder - er påkrævet for at rhodopsin kan binde til arrestin, ligesom kombinationen til et pengeskab. Når den er færdig, denne interaktion starter en gren af et komplekst cellulært kommunikationsnetværk, der regulerer funktioner i hele kroppen.
"Det store spørgsmål blev så, 'Hvis dette sker med rhodopsin og arrestin, sker det i alle GPCR'er?'" sagde Parker de Waal, en Van Andel Institute Graduate School -elev og medlem af Xus laboratorium. "Vores resultater indikerer, at disse koder - disse specifikke sekvenser af phosphorylgrupper - findes helt eller delvist i de fleste GPCR'er. Resultaterne hjælper elegant med at løse et langvarigt spørgsmål inden for vores felt; hvorfor visse GPCR'er binder arrestiner bedre end andre, kan nu forklares ved eksistensen af phosphoryleringskoder."
Et værktøj til at udforske udbredelsen af disse koder på tværs af annoterede GPCR-data eksisterede ikke, så de Waal skabte en. Dels web-GUI og dels Python-baseret kommandolinjeværktøj, PhosCoFinder gjorde det muligt for holdet hurtigt at søge gennem det samlede sæt af alle kendte GPCR'er og forudsige potentielle fosforyleringskoder.
Som forventet, mere end halvdelen af de 825 GPCR'er, der blev scannet af PhosCoFinder, viste sig at indeholde phosphoryleringskoder i deres C-terminale hale, en del af GPCR'en, der hjælper med at overføre information fra cellens miljø til indersiden af cellen. De fleste af de resterende GPCR'er viste sig også at have koder; imidlertid, de var placeret i andre områder end deres C-terminale haler, muligvis påvirke den måde, de binder sig til arrestiner. De næste skridt, Xu siger, skal undersøge, om disse fund gælder for alle GPCR'er og andre celleoverfladeproteiner, der interagerer med arrestin.
"Med biologi, der er altid mere end én måde at gøre tingene på, "Sagde Xu." Vi vil også følge de andre veje i håb om, at de hjælper os med at forstå disse kritiske mekanismer yderligere. "
 Varme artikler
Varme artikler
-
 Brændstof ud af den blå luft:Ny vej til opsamling og opgradering af CO2Geonhui Lee, Ph.d. -kandidat, driver en elektrolysator, der er i stand til at omdanne opløst carbonat til CO2 og derefter til syngas. Enheden tilbyder en ny, kortere vej til omdannelse af atmosfærisk
Brændstof ud af den blå luft:Ny vej til opsamling og opgradering af CO2Geonhui Lee, Ph.d. -kandidat, driver en elektrolysator, der er i stand til at omdanne opløst carbonat til CO2 og derefter til syngas. Enheden tilbyder en ny, kortere vej til omdannelse af atmosfærisk -
 Højhastigheds- og langtidsholdbart lithium-ion-batteri med forbedret ydeevne ved lav temperatur gen…Kredit:Wiley Når det er koldt om vinteren, biler har en tendens til at have startproblemer. Dette er ikke meget bedre med elbiler, som uundgåeligt mister kapaciteten af deres genopladelige lithi
Højhastigheds- og langtidsholdbart lithium-ion-batteri med forbedret ydeevne ved lav temperatur gen…Kredit:Wiley Når det er koldt om vinteren, biler har en tendens til at have startproblemer. Dette er ikke meget bedre med elbiler, som uundgåeligt mister kapaciteten af deres genopladelige lithi -
 Analyse af fingermærker med synkrotronteknikker giver ny indsigtKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Resultaterne af ledende forskere Prof Simon Lewis og Dr. Mark Hackett kan give muligheder for at optimere nuværende fingermærk
Analyse af fingermærker med synkrotronteknikker giver ny indsigtKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Resultaterne af ledende forskere Prof Simon Lewis og Dr. Mark Hackett kan give muligheder for at optimere nuværende fingermærk -
 Enkel og omkostningseffektiv udvinding af sjældne metaller fra industriaffaldKredit:CC0 Public Domain Mange sjældne metaller er mangelfulde, alligevel efterspørgsel efter brug i elektronik, medicinsk instrumentering, og andre formål fortsætter med at stige. Som affald, dis
Enkel og omkostningseffektiv udvinding af sjældne metaller fra industriaffaldKredit:CC0 Public Domain Mange sjældne metaller er mangelfulde, alligevel efterspørgsel efter brug i elektronik, medicinsk instrumentering, og andre formål fortsætter med at stige. Som affald, dis
- Chimpanse Parringvaner
- Runaway minetog kører 90 kilometer uden chauffør
- Lys, kamera, action ... den superhurtige verden af dråbedynamik
- Tynde eksplosive film giver et øjebliksbillede af, hvordan detonationer starter
- Frankrig begynder processen med at tildele 5G -frekvenser:regulator
- En ny måde at lede efter gravitationsbølger på


