Krystallografi giver slagplan-planer til at angribe sygdomsfremkaldende bakterier
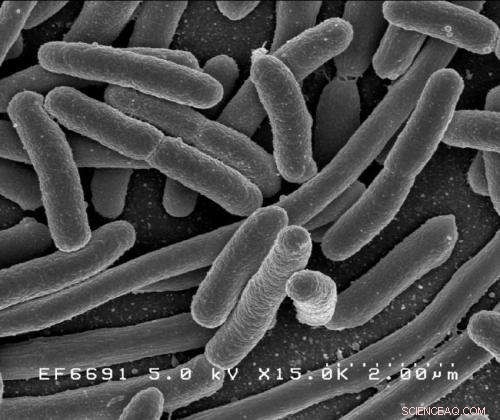
Escherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH
Forskere fra Trinity College Dublin har opnået vigtig strukturel indsigt i det maskineri, der anvendes af opportunistiske, sygdomsfremkaldende bakterier, som kan hjælpe kemikere med at designe nye lægemidler til at hæmme dem.
Forskerne, ledet af Fellow Emeritus i Trinity's School of Biochemistry and Immunology, Professor Martin Caffrey, brugt næste generations røntgenkrystallografiteknikker til at 'se under bakteriehjelmen' og producere en molekylær plan, der kan bruges til at designe lægemidler, der minimerer virkninger uden for mål og angriber eventuelle strukturelle svagheder.
Forskningen, som viser, at et nøgleenzym bruges i de almindelige bakterier Pseudomonas aeruginosa og Escherichia coli er bemærkelsesværdigt ens i strukturen i begge arter, er for nylig blevet publiceret i førende internationalt tidsskrift Naturkommunikation . Disse to bakterier inficerer opportunistisk mennesker, og kan forårsage dødsfald.
Professor Caffrey sagde:"De strukturelle tegninger af de to bakterier - selv om de er meget ens - adskiller sig i deres fine detaljer. Disse subtile forskelle kan udnyttes til at designe artsspecifikke terapier med en reduceret sandsynlighed for udvikling af antibiotikaresistens."
Begge Pseudomonas aeruginosa og Escherichia coli er medicinsk vigtige, forårsager problemer hos titusindvis af patienter hvert år. Begge er kendt for at have udviklet resistens over for et væld af førstevalgsmedicin, der bruges til at behandle dem. Og med antimikrobiel resistens generelt stigende, Verdenssundhedsorganisationen har meddelt, at en post-antibiotisk æra, hvor mindre skader og almindelige infektioner kan vise sig dødelige, truer.
Der er hårdt brug for nye stoffer. Imidlertid, mens den nye plan for det bakterielle enzym 'Lnt' giver håb for udvikling af lægemidler, processen med at skabe effektive kandidater er ikke let.
For det første, lignende enzymer er til stede i mennesker og andre dyr, så ethvert lægemiddel skal være tilstrækkeligt specifikt til kun at påvirke det bakterielle enzym. For det andet den biologiske struktur af ethvert lægemiddel, der ville binde til de bakterielle enzymer og hæmme dem, vil sandsynligvis svare til strukturen af molekyler, der hæmmer det medfødte immunrespons. Med andre ord, at stoppe bakterierne i dens spor kan også bremse kroppens naturlige reaktion på infektion.
Når vi taler om vanskeligheden ved at designe "silver-bullet" stoffer, der kan vende udviklingen, og om de næste skridt i hans teams arbejde, Professor Caffrey tilføjede:"De strukturelle tegninger, der er genereret som en del af denne undersøgelse, giver et grundlag, hvorved forskellene mellem det bakterielle enzym og immunresponsproteinerne kan udnyttes med det mål at producere et lægemiddel, der kun rammer det bakterielle mål."
 Varme artikler
Varme artikler
-
 Kemikere skaber ny krystalform for insekticid, øger dets evne til at bekæmpe myg og malariaNew York University-forskere har skabt en ny krystalform af deltamethrin - et almindeligt insekticid, der bruges til at kontrollere malaria - hvilket resulterer i et insekticid, der er op til 12 gange
Kemikere skaber ny krystalform for insekticid, øger dets evne til at bekæmpe myg og malariaNew York University-forskere har skabt en ny krystalform af deltamethrin - et almindeligt insekticid, der bruges til at kontrollere malaria - hvilket resulterer i et insekticid, der er op til 12 gange -
 Ny kerne-skal katalysator til ethanol brændselscellerEt nærbillede af platin/iridium (grøn/blå) skallen over en guld nanopartikelkerne (gul), viser, hvordan denne katalysator spalter carbon-carbon (grå) bindingerne i ethanol, mens den oprindeligt efterl
Ny kerne-skal katalysator til ethanol brændselscellerEt nærbillede af platin/iridium (grøn/blå) skallen over en guld nanopartikelkerne (gul), viser, hvordan denne katalysator spalter carbon-carbon (grå) bindingerne i ethanol, mens den oprindeligt efterl -
 Biologer opdager carotenoidoverførsel mellem to proteinerCover art til denne artikel minder om coveret til albummet The Dark Side of the Moon af Pink Floyd. Det viser, hvor rødt, lilla, orange og violette proteiner kan fås fra et farveløst protein og en typ
Biologer opdager carotenoidoverførsel mellem to proteinerCover art til denne artikel minder om coveret til albummet The Dark Side of the Moon af Pink Floyd. Det viser, hvor rødt, lilla, orange og violette proteiner kan fås fra et farveløst protein og en typ -
 Sådan opløses sukker hurtigereDu kan muligvis ikke se det sukker, du har omrørt i din te, kaffe eller varm chokolade, men det er stadig der. I stedet for at forsvinde helt, opløses det. Når et opløst stof opløses i et andet stof,
Sådan opløses sukker hurtigereDu kan muligvis ikke se det sukker, du har omrørt i din te, kaffe eller varm chokolade, men det er stadig der. I stedet for at forsvinde helt, opløses det. Når et opløst stof opløses i et andet stof,


