Forskere skaber biomateriale, der leverer både et kraftfuldt lægemiddel og gendæmpere
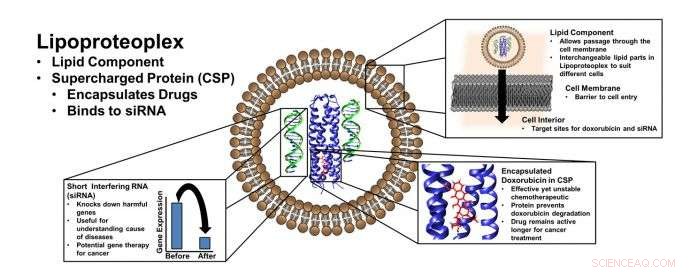
Lipoproteoplex bruger en lipid-"beholder" til transfektion - transport af materiale forbi en cellemembran - og en proteinkapsel, der er nem at fremstille, der kan binde både små molekyle kemoterapeutiske lægemidler og genetisk teknologi, såsom kort interfererende RNA (siRNA), der kan "dæmpe" gener, der udbreder sygdomstilstande. Kredit:NYU Tandon School of Engineering
Klinikere har i dag et arsenal på mere end 200 lægemidler til deres rådighed til behandling af en række kræftformer - 68 lægemidler blev godkendt alene mellem 2011 og 2016. Men mange kemoterapeutiske midler udgør genstridige udfordringer:de forårsager alvorlige bivirkninger, fordi de ud over kræftceller dræber sunde celler; nogle former for kræft udvikler resistens over for lægemidler; og mange sådanne kemoterapier, er dårligt vandopløseligt, demonstrere lav biotilgængelighed, hvilket resulterer i sub-optimal lægemiddellevering til kræftceller.
En potentiel løsning ligger i den synergistiske kombination af et kemoterapeutisk lægemiddel med manipuleret genetisk materiale designet til at neutralisere de ondsindede gener, der giver resistens over for det pågældende lægemiddel. blandt andre funktioner.
Mens der er adskillige eksempler på syntetiske dobbelte gen- og lægemiddelleveringsmedier, nye hybridmaterialer udviklet i laboratoriet på NYU Tandon School of Engineering bruger let modificerbare proteiner til at levere en kemisk en-to-punch:de kombinerer en lipid-"beholder" til transfektion - transporten af last forbi en cellemembran - og en let- at lave proteinkapsel, der kan binde både små kemoterapeutiske molekyler og nukleinsyrer.
Udviklet af et team ledet af NYU Tandon Associate Professor of Chemical and Biomolecular Engineering Jin Kim Montclare - der også fungerer som tilknyttet professor i kemi ved NYU's College of Arts and Sciences, og en tilknyttet professor i biomaterialer ved NYU College of Dentistry, samt at være tilknyttet SUNY Downstate som professor i biokemi - det hybride lipid-protein-materiale, kaldet en lipoproteoplex, omfatter både et oprullet superladet proteinmakromolekyle og et kommercielt tilgængeligt transfektionsmiddel kaldet Lipofectamine 2000.
Fordi forskerne konstruerede proteinmakromolekylet med omfattende positive ladninger på overfladen og en hydrofob kerne, det kan nemt pyntes med negativt ladet kort interfererende RNA (siRNA) – et kraftfuldt værktøj til at undertrykke gener, der fremkalder lægemiddelresistens og udbreder sygdomstilstande – mens det også fungerer som et effektivt, og toksicitetsreducerende, carryall for det hydrofobe kemoterapeutiske middel doxorubicin.
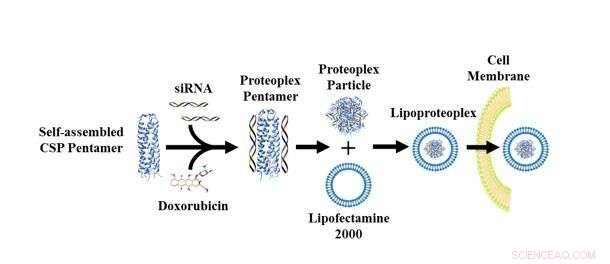
Lipoproteoplex giver forskere mulighed for at udskifte et superladet protein eller lipidkomponent og et hvilket som helst antal siRNA for at adressere en specifik cellelinje og type lægemiddel. Kredit:NYU Tandon School of Engineering
I forskning offentliggjort i Biomakromolekyler , et tidsskrift fra American Chemical Society, holdet beskriver, hvordan lipoproteoplex eksponeret for prøver af MCF-7 brystkræftcellelinjen leverede mere doxorubicin til målceller end Lipofectamine 2000 alene, resulterer i et væsentligt fald i MCF-7-cellelevedygtighed. De demonstrerede også, at hybridmakromolekylet var meget vellykket ved siRNA-transfektion, dæmper genet med 60 pct.
Montclare sagde, at en vigtig fordel ved den nye lipoproteoplex er nem modifikation, et aktiv for forskere, der studerer celler, hvis genetisk påkaldte adfærd ændrer sig over tid og adskiller sig fra cellelinje og patient. Snarere som et system af mix-and-match-komponenter, lipoproteoplexet giver forskere mulighed for at udskifte et superladet protein eller lipidkomponent og et hvilket som helst antal siRNA for at adressere en specifik cellelinje og type lægemiddel.
"I modsætning til andre bestræbelser på at producere dobbelte gen- og lægemiddelleveringssystemer, denne tilgang kræver ikke kedelige kemiske synteseprocedurer; snarere kan vi biosyntetisere enhver variant af det superladede protein, " sagde hun. "Dette giver mulighed for at erstatte forskellige siRNA-molekyler og kemoterapeutiske lægemidler, så de passer til laboratoriets behov."
I nyere arbejde med proteinbaserede hybridmaterialer, Montclare og hendes samarbejdspartnere kombinerede et konstrueret superladet protein med transfektionsreagenset Fugene. Kombinationen udviste en otte gange forbedring i transfektionseffektiviteten af DNA sammenlignet med Fugene alene, med ubetydelig cytotoksicitet.
Montclare undersøger mekanismerne, der gør disse lipoproteoplexes i stand til effektivt at levere gener og lægemidler på tværs af forskellige cellelinjer.
 Varme artikler
Varme artikler
-
 Fra gamle jeans til ny T-shirtviklet op på en spole, viskosefilamentgarnet blev spundet af genbrugsbomuld tilvejebragt i form af celluloseark. Forskere ved Fraunhofer IAP har fundet en måde at forvandle bomuldstøj som jeans til ny
Fra gamle jeans til ny T-shirtviklet op på en spole, viskosefilamentgarnet blev spundet af genbrugsbomuld tilvejebragt i form af celluloseark. Forskere ved Fraunhofer IAP har fundet en måde at forvandle bomuldstøj som jeans til ny -
 Hvordan påvirker koncentration reaktionshastigheden?Forøgelse af koncentrationen af reaktanter øger generelt reaktionshastigheden, fordi flere af de reagerende molekyler eller ioner er til stede for at danne reaktionsprodukter. Dette gælder især, når
Hvordan påvirker koncentration reaktionshastigheden?Forøgelse af koncentrationen af reaktanter øger generelt reaktionshastigheden, fordi flere af de reagerende molekyler eller ioner er til stede for at danne reaktionsprodukter. Dette gælder især, når -
 Mod udvikling af lægemidler til aldringsrelaterede sygdommeSirt6-aktivatorerne UBCS039 (cyan, foran til venstre) og MDL-801 (flerfarvet, foran til højre) er forankret i den samme bindingslomme på Sirt6. Det længere MDL-801-molekyle kontakter også tilstødende
Mod udvikling af lægemidler til aldringsrelaterede sygdommeSirt6-aktivatorerne UBCS039 (cyan, foran til venstre) og MDL-801 (flerfarvet, foran til højre) er forankret i den samme bindingslomme på Sirt6. Det længere MDL-801-molekyle kontakter også tilstødende -
 Gennembrud hurtigt, massescreening for ebola-virusEbola virus. Kredit:Northumbria University En ny, en hurtigere og sikrere måde at diagnosticere ebola-virus på er udviklet af en akademiker fra Northumbria University, Newcastle. Forskning ledet
Gennembrud hurtigt, massescreening for ebola-virusEbola virus. Kredit:Northumbria University En ny, en hurtigere og sikrere måde at diagnosticere ebola-virus på er udviklet af en akademiker fra Northumbria University, Newcastle. Forskning ledet
- Lodrette målinger af luftforurenende stoffer i byerne Beijing
- Snesevis af forhistoriske, Romerske og middelalderlige steder opdaget af arkæologiske frivillige, d…
- Alexa, gem ikke denne optagelse:Californien -regningen er målrettet til smarthøjttalere
- Amazons TV-aftale med Jordan Peele er blandt de hidtil højest profilerede for streamingtjenester
- Smart væske bliver mørk i varmen
- Skoler flytter online, men ikke alle børn starter digitalt lige


