Mod udvikling af lægemidler til aldringsrelaterede sygdomme
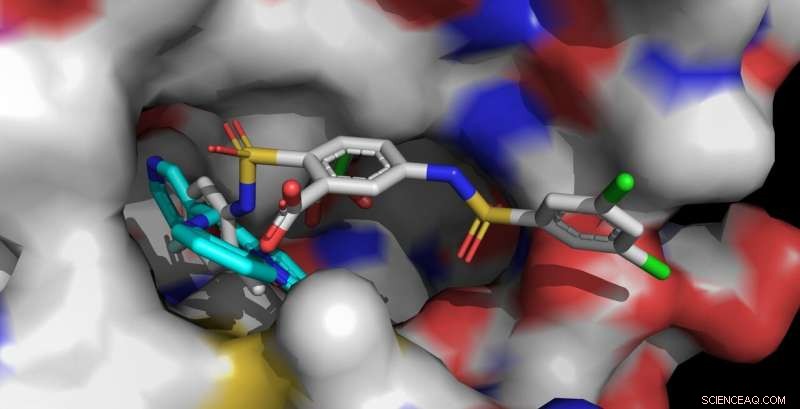
Sirt6-aktivatorerne UBCS039 (cyan, foran til venstre) og MDL-801 (flerfarvet, foran til højre) er forankret i den samme bindingslomme på Sirt6. Det længere MDL-801-molekyle kontakter også tilstødende overfladeområder og interagerer stærkere med Sirt6. Kredit:Clemens Steegborn
I søgen efter måder at effektivt bekæmpe aldersrelateret menneskelig sygdom, enzymet sirtuin 6 (Sirt6) er for nylig blevet et fokusområde for biokemisk forskning. En målrettet aktivering af Sirt6 kunne forebygge eller lindre sådanne sygdomme, for eksempel nogle former for kræft. I et papir til bladet Naturens kemiske biologi , biokemikere fra University of Bayreuth har nu vist, hvordan det lille molekyle MDL-801 binder sig til enzymet Sirt6 og påvirker dets aktivitet. Disse resultater kan hjælpe med udviklingen af nye lægemidler.
Den menneskelige krop indeholder syv forskellige sirtuiner, navngivet Sirt1 til Sirt7. Disse enzymer spiller en væsentlig rolle i reguleringen af stofskiftet og stressreaktioner. I de seneste år, forskerholdet ledet af prof. dr. Clemens Steegborn ved University of Bayreuth har i flere forskningsartikler vist, hvordan Sirt6 kan aktiveres af små molekyler. Med deres studie, nu udgivet i Naturens kemiske biologi , Steegborn og hans forskningsassistent Dr. Weijie Du har fulgt op på disse resultater. De fandt ud af, at molekylet MDL-801 interagerer med Sirt6 ved at bruge et unikt strukturelt træk ved dette enzym:en usædvanlig bred bindingslomme, der er let tilgængelig udefra og normalt er involveret i interaktion med substratproteiner. Dette molekylære hulrum fortsætter i en åben kanal, der fører til det katalytiske centrum af Sirt6. Det er i denne kanal, karakteristisk for Sirt6, at MDL-801 forankrer, når det aktiverer enzymet. Hovedsageligt gennem aktivitetsundersøgelser og røntgenstrukturanalyser, Steegborn og You var i stand til at identificere både bindingsstedet og molekylære processer involveret i aktiveringen af Sirt6 af MDL-801.
Som Bayreuth-biokemikerne allerede har vist i tidligere undersøgelser, de aktive stoffer UBCS039, quercetin, og fluvastatin er også i stand til at aktivere Sirt6. For at gøre det, de bruger den samme åbne kanal, som MDL-801 docker i. Dette aflange hulrum kaldes også acylkanalen. Så snart Sirt6 er i en aktiveret tilstand, det spalter acylgrupper fra proteiner. Derved, det påvirker, blandt andet, syntese af proteiner styret af gener. Fund om aktiveringen af Sirt6 giver derfor værdifulde spor for udviklingen af aktive stoffer, der kan modvirke aldringsrelaterede sygdomme – for eksempel udvikling af tumorer.
"Alle små molekyler, for hvilke vi hidtil har været i stand til at påvise en aktiverende effekt på Sirt6, bruger acylkanalen til at binde sig til Sirtuin 6. Og selvom deres kemiske strukturer er meget forskellige, de gør dette på meget lignende måder. Dette åbner mulighed for, at vi kan bruge detaljerne om deres respektive interaktioner til at finjustere aktiverende forbindelser. Sådanne lægemidler ville så være i stand til at regulere Sirt6 på en bestemt måde. Derved, de kunne bruges på en målrettet måde til at forebygge eller helbrede sygdomme forbundet med aldringsprocessen, siger Steegborn.
Med deres nye undersøgelse, Steegborn og Du har tilbagevist en nøgleerklæring, som en forskergruppe i Shanghai publicerede i Naturens kemiske biologi i 2018. I dette papir MDL-801 blev beskrevet som en ny Sirt6-aktivator. En røntgenkrystallografisk struktur blev brugt til at vise, at MDL-801 binder til en anden molekylær sektion af Sirt6 end andre aktivatorer. "Denne struktur, som skyldes en fejlfortolkning af eksperimentelle data, har vildledt adskillige forskerhold siden offentliggørelsen. Vores undersøgelse retter denne fejl og gør det således muligt at arbejde effektivt med forbedrede aktivatorer, siger Steegborn.
Sidste artikelEn materialevidenskabelig tilgang til bekæmpelse af coronavirus
Næste artikelKampen mod svære at behandle svampeinfektioner
 Varme artikler
Varme artikler
-
 Forskning i nitrogenfiksering kunne kaste lys over biologisk mystikGødning tilføres en landbrugsmark. Kredit:SoilScience.info (CC BY 2.0) Inspireret af en naturlig proces fundet i visse bakterier, et hold af Caltech-forskere rykker tættere på en ny metode til at
Forskning i nitrogenfiksering kunne kaste lys over biologisk mystikGødning tilføres en landbrugsmark. Kredit:SoilScience.info (CC BY 2.0) Inspireret af en naturlig proces fundet i visse bakterier, et hold af Caltech-forskere rykker tættere på en ny metode til at -
 Stabile radikaler kan løse ukonventionelle problemer i moderne videnskab og teknologiPavel Petunin. Kredit:Tomsk Polytechnic Verdazyl-radikaler er stabile molekyler, der indgår i en række organiske stoffer. Du kan bogstaveligt talt fornemme, røre ved, og se dem. Vigtigere, de kan
Stabile radikaler kan løse ukonventionelle problemer i moderne videnskab og teknologiPavel Petunin. Kredit:Tomsk Polytechnic Verdazyl-radikaler er stabile molekyler, der indgår i en række organiske stoffer. Du kan bogstaveligt talt fornemme, røre ved, og se dem. Vigtigere, de kan -
 Hvilke lipider er vandopløselige?Lipider er en klasse af molekyler, der pr. definition er meget dårlig vandopløselighed. Som sådan er det enkleste svar på spørgsmålet om, hvilke lipider der er vandopløseligt, ingen af dem. Der e
Hvilke lipider er vandopløselige?Lipider er en klasse af molekyler, der pr. definition er meget dårlig vandopløselighed. Som sådan er det enkleste svar på spørgsmålet om, hvilke lipider der er vandopløseligt, ingen af dem. Der e -
 Forskere afslører skjulte genetikregler for, hvordan livet på Jorden begyndteI begyndelsen, på en eller anden måde blev grundlæggende genetiske byggesten omsat til proteiner for at føre til komplekst liv, som vi kender det. Kredit:Christ-claude Mowandza-ndinga Alle levende
Forskere afslører skjulte genetikregler for, hvordan livet på Jorden begyndteI begyndelsen, på en eller anden måde blev grundlæggende genetiske byggesten omsat til proteiner for at føre til komplekst liv, som vi kender det. Kredit:Christ-claude Mowandza-ndinga Alle levende
- Semeru-vulkanen på Indonesiens Java-ø udspyder varme skyer
- Ny metode til isolering af tumorceller kan forbedre kræftforskning og -behandling
- Sådan Siphon Vand opad til et Science Experiment
- Wide learning AI-teknologi muliggør meget præcis læring selv fra ubalancerede datasæt
- Golfstrømmen er ved at bremse. Det kan betyde stigende hav og et varmere Florida
- Isrige strømningstræk på Mars sydlige halvkugle afslører virkningerne af de seneste klimacykluss…


