Undersøgelse afslører, hvordan iltfattigt protein binder løst til et mineral
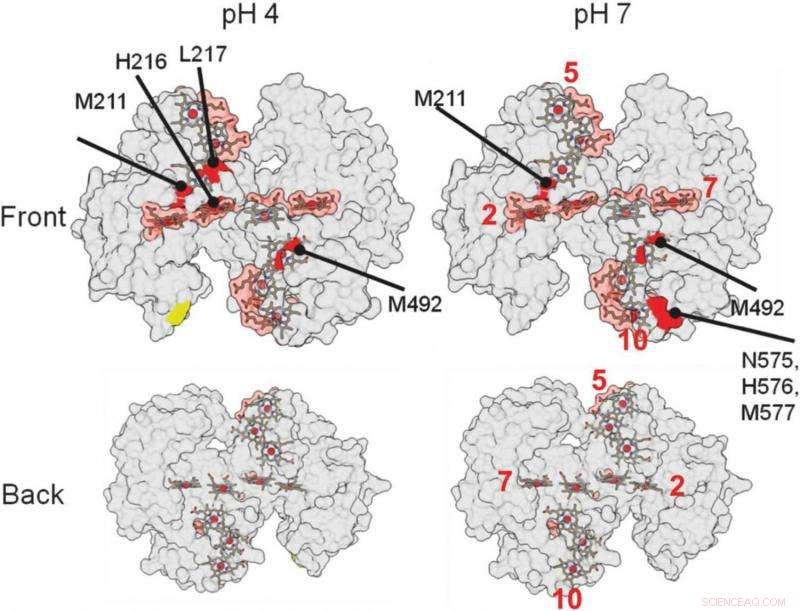
ud på disse 3-D strukturelle gengivelser af proteinet, hjulpet forskere med at identificere, hvor proteinet binder til et mineral. De røde områder angiver mulige bindingsområder. Kredit:Berkeley Lab
Forskere har opdaget detaljerne i en ukonventionel kobling mellem et bakterielt protein og et mineral, der gør det muligt for bakterien at trække vejret, når ilt ikke er tilgængeligt.
Forskningen, udført af et team af forskere ved Department of Energy's Lawrence Berkeley National Laboratory (Berkeley Lab), kan føre til nye innovationer i at forbinde proteiner med andre materialer til biobaserede elektroniske enheder - såsom sensorer, der kan diagnosticere sygdom eller opdage forurenende stoffer. Det kunne også hjælpe forskere med at forstå og kontrollere de kemiske reaktioner, der udløses af disse protein-materiale-interaktioner.
"At flytte elektroner til metaller kan få forskellige mineraler til at vokse eller opløses. At studere, hvordan et protein gør dette, kan hjælpe os med at forstå både, hvordan organismer omformer deres miljø og laver biomineraler til tænder eller beskyttelse, " sagde Caroline Ajo-Franklin, en stabsforsker i Biological Nanostructures Facility på Berkeley Labs Molecular Foundry, som er et forskningscenter for nanovidenskab.
Ajo-Franklin ledede undersøgelsen, offentliggjort online i Journal of the American Chemical Society tidligere på måneden.
"At forstå, hvordan disse interaktioner mellem proteiner og materialer ser ud, kan hjælpe os med at designe dem bedre, " tilføjede hun, "og giv os indsigt i, hvordan man forbinder levende celler med enheder."
Forskere stolede på en røntgenbaseret teknik ved Berkeley Labs Advanced Light Source (ALS), kendt som "fodaftryk, "for at lokalisere de kemiske forbindelser mellem det bakterielle protein og nanopartikler sammensat af jern og ilt.
Studiet, som identificerede et overraskende lille og svagt bindingssted, også nydt godt af værktøjer og ekspertise på Lab's Molecular Foundry; og det Lab-ledede Joint BioEnergy Institute, som er specialiseret i forskning i biobrændstoffer.
Strukturen af dette eksotiske protein var tidligere blevet kortlagt isoleret med detaljer i atomare skala af andre forskergrupper ved hjælp af røntgenkrystallografi, hvilket krævede en krystalliseret form af proteinet. Men forskerne vidste ikke, hvordan det bandt sig til det metalholdige mineral - konventionelle teknikker kan ikke se denne bindingsproces.

Sayan Gupta, en røntgen-fodaftryksekspert, demonstrerer en type prøveholder, der blev brugt til at studere, hvordan et protein binder til et mineral. Kredit:Paul Mueller
I 2014 Ajo-Franklin lærte af Corie Ralston, en anden laboratorieforsker, der arbejder i afdelingen Molecular Biophysics and Integrated Bioimaging (MBIB), om røntgenmassespektrometri-fodaftryksteknikken, en innovativ måde at præcist sondere proteiner og deres omgivelser med røntgenstråler ved ALS.
Ajo-Franklin og Ralston forfulgte hver især separate laboratoriestyrede forsknings- og udviklingsprojekter, og de så, at de to indsatser faktisk kunne være komplementære.
Ralston havde taget røntgen-footprinting-teknikken til sig fra sin tidligere rådgiver, Mark Chance, en professor ved Case Western Reserve University, der etablerede røntgen-footprinting-teknikken ved Brookhaven National Laboratory på Long Island, N.Y. Denne røntgenteknik er kun tilgængelig hos ALS og Brookhaven's National Synchrotron Light Source II (NSLS-II).
"Fodaftryk kan fortælle dig, hvordan proteiner interagerer, " Ralston sagde. "Det kan give strukturelle og dynamiske oplysninger om proteiner tæt på deres oprindelige miljø."
Proteinet udvalgt til undersøgelsen er fra en metalreducerende bakterie, Shewanella oneidensis, som "spiser sukker og dybest set indånder mineraler", når der ikke er ilt til rådighed, Ajo-Franklin bemærkede. "En af grundene til, at disse organismer er så sjove at studere, er, at de interagerer med en bred vifte af materialer."
Efter Tatsuya Fukushima, en tidligere laboratorieforsker, der var medforfatter af undersøgelsen, fundet en passende måde at forberede proteinet og nanopartiklerne i en flydende opløsning til røntgenundersøgelser, Sayan Gupta, en røntgen-footprinting-ekspert i Berkeley Labs MBIB-afdeling, brugte en røntgenstrålelinje ved ALS til at studere prøverne.
"Vi fanger øjebliksbillederne af tilstanden af dette molekyle på et bestemt tidspunkt, " sagde Gupta. "Det er en simpel teknik og giver dig masser af information om et proteins oprindelige tilstand."
I denne teknik, Røntgenstråler producerer meget reaktive molekyler kendt som hydroxylradikaler, når de passerer gennem den flydende opløsning, der omgiver proteinet. Disse radikaler modificerer proteinet på en måde, der gør det muligt for forskere at lokalisere små kemiske variationer, hvor proteinet er i kontakt med opløsningen.
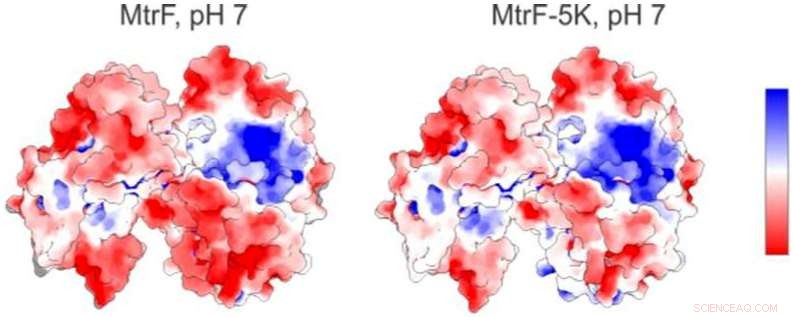
Et elektrostatisk kort (til venstre) af et protein studeret ved Berkeley Labs Advanced Light Source viser positivt ladede (blå) og negativt ladede (røde) områder. Til højre er et forudsagt elektrostatisk kort for en mutant form af proteinet. Kredit:Berkeley Lab
De områder af proteinet, der interagerer med andre proteiner eller materialer, er beskyttet mod radikalerne og ikke udsat for de kemiske ændringer. De steder, hvor proteinet ikke er ændret, angiver, hvor bindingen finder sted.
I den seneste undersøgelse, disse kemiske snapshots produceret ved hjælp af røntgen-footprinting-teknikken på forskellige tidspunkter blev efterfølgende analyseret ved hjælp af en teknik kendt som massespektrometri på Joint BioEnergy Institute.
En detaljeret analyse af Fukushima afslørede, hvordan proteinet forbindes med mineralet.
"Det største fund, det var ret overraskende, var, at vores proteiner binder relativt svagt, "Ajo-Franklin sagde. "De fleste proteiner, der interfacer med materialer, binder virkelig tæt, " skifter form, efterhånden som de danner denne forbindelse. Dette særlige protein ser ikke ud til at ændre form overhovedet og interagerer kun med mineralet i et lille område, kræver omkring fem gange mindre bindingsenergi, til sammenligning, end typiske proteiner, der danner biomineraler.
Det giver faktisk meget mening, tilføjede hun. "Dette proteins opgave er at overføre elektroner til mineralet, så det behøver ikke at være i kontakt ret længe."
Forskerholdet arbejder nu på at undersøge, hvordan dette og lignende proteiner interagerer med en række mineraler.
"Der er en masse proteiner i denne familie, "Ajo-Franklin sagde. "Vi er virkelig spændte på at se, hvordan disse proteiner interagerer med forskellige materialer. Bruger de alle den samme bindingsstrategi?"
Denne undersøgelse giver allerede ideer til, hvordan man redesigner disse proteiner for at skabe bedre elektroniske forbindelser og dermed mere følsomme bioelektroniske sensorer – et projekt Ajo-Franklin arbejder på.
 Varme artikler
Varme artikler
-
 Effektiv brintomdannelse gennem solvandsopdeling ved hjælp af hæmatitmesokrystalbaserede fotoanode…Figur 1:STEM-EELS-analyse viser fordelingen af jernoxid og iltfaciliteter (Vo) i mesokrystaller. (a) EEL (Electron Energy Loss) spektre af Fe L 2, 3 ved hjælp af multivariat analyse. (b) Billede a
Effektiv brintomdannelse gennem solvandsopdeling ved hjælp af hæmatitmesokrystalbaserede fotoanode…Figur 1:STEM-EELS-analyse viser fordelingen af jernoxid og iltfaciliteter (Vo) i mesokrystaller. (a) EEL (Electron Energy Loss) spektre af Fe L 2, 3 ved hjælp af multivariat analyse. (b) Billede a -
 Forskning ser på materialets friktionsegenskaberSandia National Laboratories forskere Michael Chandross, venstre, og Nicolas Argibay viser en computersimulering og et ultrahøjt vakuum tribometer brugt til friktions- og slidtest, som er blandt de væ
Forskning ser på materialets friktionsegenskaberSandia National Laboratories forskere Michael Chandross, venstre, og Nicolas Argibay viser en computersimulering og et ultrahøjt vakuum tribometer brugt til friktions- og slidtest, som er blandt de væ -
 Minimering af termisk ledningsevne af krystallinsk materiale med optimal nanostrukturDen optimale nanostruktur designet med MI (aperiodisk supergitterstruktur) blev faktisk fremstillet, og den optimale ydeevne blev verificeret ved at vurdere dens varmeledningsevne. Figur:Den faktiske
Minimering af termisk ledningsevne af krystallinsk materiale med optimal nanostrukturDen optimale nanostruktur designet med MI (aperiodisk supergitterstruktur) blev faktisk fremstillet, og den optimale ydeevne blev verificeret ved at vurdere dens varmeledningsevne. Figur:Den faktiske -
 En ny metode kan gøre tomater mere sikre at spiseKredit:CC0 Public Domain Når grøntsagsbønder høster afgrøder, de er ofte afhængige af vask efter høst for at reducere eventuelle fødevarebårne patogener, men en ny University of Georgia-undersøgel
En ny metode kan gøre tomater mere sikre at spiseKredit:CC0 Public Domain Når grøntsagsbønder høster afgrøder, de er ofte afhængige af vask efter høst for at reducere eventuelle fødevarebårne patogener, men en ny University of Georgia-undersøgel
- Amerikanerne ønsker, at regeringen skal håndtere COVID-19 frem for alt andet, undersøgelse finder
- Sjov eksploderende videnskabseksperimenter
- Bionedbrydelige biopolymer-nanopartikler lover et tvillingangreb på brystkræft
- NASA opdager en formindsket, men gennemblødende ex-Tropical Cyclone Don
- Virtual reality-skove kan hjælpe med forståelsen af klimaændringer
- Et samlet kort på næsten 15, 000 støvstorme på Mars


