Kunstige enzymfunktioner samt naturlig version
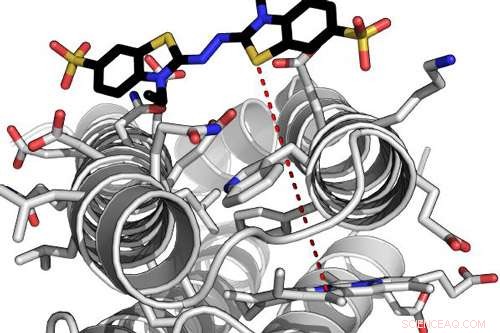
Beregningsmodel for et yderst effektivt de novo -enzym, der interagerer med et af dets substrater. Den røde stiplede linje angiver elektrontunnelafstanden mellem det proteinbundne hæmmolekyle og det bundne substrat. Kredit:Ross Anderson, University of Bristol
Forskere fra University of Bristol har designet et kunstigt enzym, der fungerer så godt som (og i nogle tilfælde bedre end) en vital klasse af naturlige enzymer.
Enzymer er grundlæggende vigtige biologiske molekyler, der udfører størstedelen af de kemiske reaktioner i alle levende organismer.
Disse reaktioner driver celleliv og er involveret i et stort antal processer, der er nødvendige for at give cellerne deres kemiske og fysiske egenskaber.
Desuden, mange enzymer deltager i kemiske reaktioner, der har kommerciel eller medicinsk værdi, og for hvilke vi ikke har nogen gode menneskeskabte stoffer, der kan katalysere sådanne reaktioner med samme præcision og effektivitet som enzymer.
Det kunstige enzym blev syntetiseret i en fuldt fungerende form af E. coli-bakterier og kunne være af væsentlig interesse for biotekindustrien på grund af dets industrielt relevante katalytiske aktiviteter, termisk stabilitet og kemisk resistens.
De kan endda bruges som erstatninger for visse naturlige enzymer, der er mere komplekse og vanskelige at producere i større skala.
For at opnå dette brugte teamet en tilgang, der eliminerer evolutionær kompleksitet ved at anvende små, enkle og helt kunstige proteiner ind i designprocessen.
Dr. Ross Anderson fra University of Bristols School of Biochemistry, sagde:"Vi beskriver disse proteiner som maquetter, et udtryk, der bruges i skulptur til at betegne en skalamodel, hvorfra et sidste værk er skabt.
"Proteinmaquetten giver designeren på samme måde mulighed for at inkorporere funktionelle elementer på et stabilt proteinstillads. I dette tilfælde, vi tilpassede et tidligere maquette -design, hvor vi brugte maskiner til stede i en levende bakteriecelle til permanent at pode hæmmolekylet ind i proteinets struktur. "
De foretagne ændringer, letter bindingen af hydrogenperoxid til hæmmolekylet et nødvendigt trin i katalyse, der er fælles for peroxidasefamilien af enzymer.
Med disse ændringer, maquetten var ikke kun i stand til at binde hydrogenperoxid, men også at omdanne det til en mere reaktiv form, der kan trække elektroner fra en række simple organiske molekyler, på samme måde som naturlige peroxidaser fungerer.
Fordi maquetten også er fuldstændigt samlet i bakterieceller, det gav teamet mulighed for at udnytte disse kemiske transformationer i levende celler, eller at overveje at integrere det i en organismes metaboliske veje.
Dr. Anderson tilføjede:"Så i det væsentlige, vi har lavet et kunstigt (eller de novo) enzym, der fungerer så godt som (og i nogle tilfælde bedre end) en vital klasse af naturlige enzymer.
"Det er promiskuøst - som mange af de naturlige peroxidaser er - og kunne stå som en robust prototype, hvorfra mange funktionelle katalysatorer kunne udvikles.
"Ved katalytisk aktivitet, det er så tæt på naturlige enzymer (og i betragtning af at bakterierne gør det i en aktiv form), hvis det blev renset uden viden om dets kunstige oprindelse, ville det blive tilskrevet en naturlig funktion og behandlet som et nyt naturligt enzym. "
 Varme artikler
Varme artikler
-
 Molekylær mekanisme for ruthenium-kompleks-induceret DNA-faseseparation afsløretMekanismerne til DNA -faseseparation induceret af rutheniumkompleks. Kredit:ZHANG Yuebin og LI Guohui Fænomenet væske-væske faseseparation (LLPS) af biologiske makromolekyler i levende celler regu
Molekylær mekanisme for ruthenium-kompleks-induceret DNA-faseseparation afsløretMekanismerne til DNA -faseseparation induceret af rutheniumkompleks. Kredit:ZHANG Yuebin og LI Guohui Fænomenet væske-væske faseseparation (LLPS) af biologiske makromolekyler i levende celler regu -
 Ny eksperimentel strategi belyser kompleks krystalstrukturForskere ved universiteterne i Warwick og Cardiff har brugt en kombineret pulver XRD, solid-state NMR og beregningsmetode til at bestemme strukturen af 3, 5-bis-O-decanoyl-2-deoxyguanosin. En kombi
Ny eksperimentel strategi belyser kompleks krystalstrukturForskere ved universiteterne i Warwick og Cardiff har brugt en kombineret pulver XRD, solid-state NMR og beregningsmetode til at bestemme strukturen af 3, 5-bis-O-decanoyl-2-deoxyguanosin. En kombi -
 Højeffektiv katalysator forbedrer den elektriske reduktionsydelse af kuldioxidKredit:CC0 Public Domain Elektrokemisk omdannelse af kuldioxid (CO 2 ) til brændstoffer og råvarer med værditilvækst, ideelt hvis drevet af vedvarende elektricitet, giver en rute til at reducere
Højeffektiv katalysator forbedrer den elektriske reduktionsydelse af kuldioxidKredit:CC0 Public Domain Elektrokemisk omdannelse af kuldioxid (CO 2 ) til brændstoffer og råvarer med værditilvækst, ideelt hvis drevet af vedvarende elektricitet, giver en rute til at reducere -
 Grønnere brint fra vandFeng Jiao, en lektor i kemisk og biomolekylær ingeniørvidenskab og associeret direktør for Center for Katalytisk Videnskab og Teknologi ved UD, i sit laboratorium. Kredit:University of Delaware Id
Grønnere brint fra vandFeng Jiao, en lektor i kemisk og biomolekylær ingeniørvidenskab og associeret direktør for Center for Katalytisk Videnskab og Teknologi ved UD, i sit laboratorium. Kredit:University of Delaware Id
- Overraskende NYC ridesharing undersøgelsesresultater har konsekvenser for politiske beslutningstage…
- Mikromotorer drives af bakterier, styret af lys
- Forskere udvikler app til at forbedre tilgængeligheden
- DNA vs RNA: Hvad er lighederne og forskellene? (med diagram)
- Hvidt kattehår på sorte bukser:Undersøgelse måler stabiliteten af præcisionsmasser til gavn f…
- Hvorfor færre amerikanere bliver skilt


