Kemikere forklarede oprindelsen til den grønne fluorescens
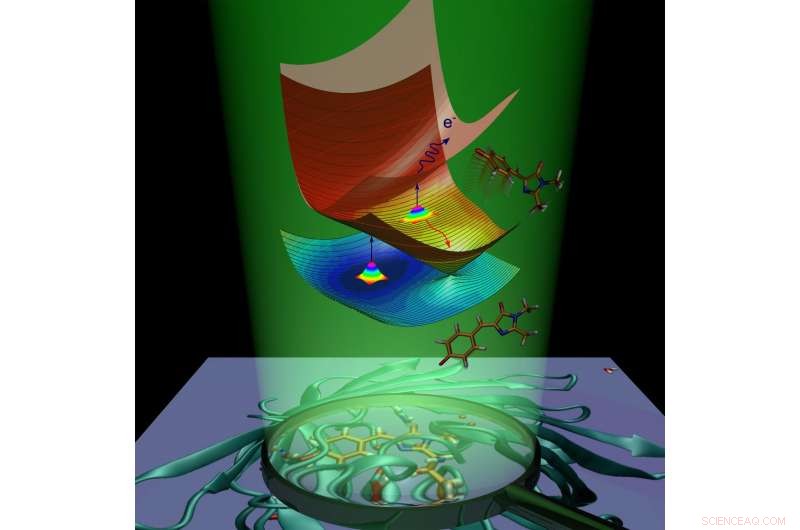
Molekylær dynamik af det grønne fluorescerende protein chromophore forårsaget af lysabsorption. Kredit:Anastasia Bochenkova
Forskere ved Lomonosov Moskva State University i samarbejde med danske molekylære fysikere har afsløret den mekanisme, der bestemmer følsomheden af grønt fluorescerende protein for lyseksponering. Forskerne har bevist, at en isoleret kromoforgruppe er i stand til at udsende lys uden for proteinmiljøet, mens proteinfunktionen er at forbedre dets fluorescerende egenskaber. Resultaterne offentliggøres i Journal of the American Chemical Society .
Proteiner fra GFP -familien bruges i vid udstrækning som biomarkører. Med deres hjælp, forskere kunne visualisere biologiske processer, der finder sted inde i levende celler. Disse proteiner er meget udbredt i molekylær og cellulær biologi på grund af deres unikke evne til at fluorescere ved absorption af lys med en bestemt bølgelængde.
Chromophore -grupper, eller kromoforer, er ansvarlige for lysabsorbering. Kromoforen består af kun tre aminosyrerester. Indtil nu, forskere mente, at proteinmiljøet fik sin kromofor til at udsende lys under bestråling. Denne idé blev understøttet af det faktum, at den isolerede kromofor mister sine fluorescerende egenskaber ved proteindaturering, dvs. udfoldelse af proteinet. For første gang, forfatterne har forudsagt og eksperimentelt bevist, at den isolerede kromofor også kan fluorescere uden for proteinmiljøet, men kun ved visse temperaturer.
Efter absorption af lys, det fluorescerende protein får ekstra energi og undergår overgang til den elektronisk ophidsede tilstand. Proteinmolekylet stræber efter at vende tilbage til grundtilstanden ved at slippe af med den overskydende energi. Denne proces kaldes deaktivering og forløber på to måder. Den første er fluorescens. I transit fra den ophidsede tilstand til grundtilstanden, kromoforen udsender energi i form af lys, og som følge heraf, proteinet bliver lysende.
Den anden måde kaldes ikke -strålende afslapning. Under denne proces, elektronisk excitationsenergi, overført til et molekyle ved lysabsorption, omdannes til vibrationsenergi af kerner. Intern omdannelse inde i det grønne fluorescerende protein efterfølges af en kemisk reaktion-cis-trans-isomerisering af kromoforen (dvs. intramolekylær rotation omkring en af dobbeltbindinger inde i molekylet).
I tilfælde af det anioniske (negativt ladede) kromofor af det grønne fluorescerende protein, energi kan også overføres til en elektron, som forlader kromoforen. Kromoforen, som gennemgår isomerisering eller mister en elektron, fjerner overskydende elektronisk energi og fluorescerer ikke. Fluorescens kaldes en strålende kanal for deaktivering, mens intern konvertering og elektronemission kaldes ikke -radiative kanaler. Forskerne har eksperimentelt brugt begge ikke-strålende kanaler til at studere ophidset tilstandsforfald og grundtilstandsgenopretning af den isolerede GFP-kromofor ved forskellige temperaturer.
Forskerne har vist, at den isolerede GFP -kromofor kan blive fanget i ophidset tilstand på grund af tilstedeværelsen af iboende energibarrierer langs de ikke -strålende deaktiveringsveje. Når chromoforen afkøles til 100 K, fangsten varer i nanosekunder, muliggør dermed den langsomme strålende kanal. De fangende barrierer forhindrer kromoforen i at vende tilbage til grundtilstanden ved hurtig ikke -strålende omdannelse og får molekylet til at fluorescere.
Kemiker Anastasia Bochenkova fra Lomonosov Moscow State University siger, "GFP -kromoforen er iboende fluorescerende. Interaktioner mellem kromoforgruppen og det nærmeste proteinmiljø forbedrer betingelserne for at fange kromoforen i den ophidsede tilstand, dermed forbedres den molekylære fluorescens. Som resultat, den strålende kanal bliver dominerende inde i proteinet allerede ved stuetemperatur. "
Forskerne har studeret kromoforegenskaberne både teoretisk og eksperimentelt. Forskerne udarbejdede en teoretisk model og anslog en levetid for den isolerede kromofor i ophidset tilstand, baseret på beregningerne på kvantekemien på højt niveau. Sådanne beregninger kræver højtydende computerressourcer, og forskerne brugte Lomonosov Supercomputing Center til deres undersøgelser.
De danske forskere designede og skabte en ny eksperimentel teknik til at studere lysinduceret molekylær dynamik af isolerede ladede kromoforer i vakuum-femtosekund pumpesonde-actionspektroskopi med 2-D tidsopløsning. Både forsinkelsestiden mellem to femtosekund -laserpulser og henfaldstiden for en bestemt molekylær virkning blev varieret. Den nye teknik løser den lysinducerede dynamik i GFP-kromoforen, som den sker i forskellige henfaldskanaler gennem både de ophidsede og jordede elektroniske tilstande, afhængig af temperatur. Baseret på resultaterne, forskerne har konkluderet, at native GFP -kromoforer iboende er i stand til at fluorescere uden for proteinmiljøet med en nanosekunders levetid, fuldt ud understøtter teoretiske forudsigelser.
Anastasia Bochenkova siger, "Vores forskning har til formål at afsløre molekylære mekanismer for levende systemers funktion. En grundlæggende udfordring er at forstå forholdet mellem egenskaberne for et helt lysfølsomt biosystem og dets meget mindre aktive kromofor, som er kernen i det molekylære maskineri. Her, vi har vist, at egenskaberne af en enkelt kromofor er vigtige for at forstå virkningsmekanismerne for hele GFP -proteinet. Denne viden er i skæringspunktet mellem fysik, kemi og biologi, og resulterer i en revision af det fremherskende paradigme om proteinmiljøets rolle i fluorescensen af GFP -proteinet. Udover at løse spørgsmålet om oprindelsen af GFP's iboende fluorescens, arbejdet viser, at detaljeret molekylær viden opnået ved hjælp af kvantkemiske beregninger på højt niveau kan bruges sammen med molekylær teknik til at designe nye funktionelle biomaterialer med optimal fotorespons. "
 Varme artikler
Varme artikler
-
 Lysinduceret modifikation af en carboxylsyre med en aminocyclopropenonFotoudløst modifikation af en carboxylsyre ved hjælp af en aminocyclopropenon. Reaktionen afsluttes på kort tid (5-10 min) selv ved lav koncentration (10-20 mM). Modifikationsreaktionen forløber i op
Lysinduceret modifikation af en carboxylsyre med en aminocyclopropenonFotoudløst modifikation af en carboxylsyre ved hjælp af en aminocyclopropenon. Reaktionen afsluttes på kort tid (5-10 min) selv ved lav koncentration (10-20 mM). Modifikationsreaktionen forløber i op -
 Ingeniører tester medicinoverførsel ved hjælp af placenta-på-en-chipHuh-laboratoriets placenta-på-en-chip har to mikrofluidiske kanaler, der repræsenterer moderens og føtale kredsløbssystemer, og en membran med levende celler fra placentabarrieren, der adskiller de to
Ingeniører tester medicinoverførsel ved hjælp af placenta-på-en-chipHuh-laboratoriets placenta-på-en-chip har to mikrofluidiske kanaler, der repræsenterer moderens og føtale kredsløbssystemer, og en membran med levende celler fra placentabarrieren, der adskiller de to -
 Secret of britisk chokoladefremstilling inspirerer til opdagelse af ny laktoseformKredit:CC0 Public Domain En ny form for krystallinsk laktose er blevet opdaget ved hjælp af en del af teknikken, der giver britisk chokolade sin unikke appel. Den nye form for laktose, en ingredi
Secret of britisk chokoladefremstilling inspirerer til opdagelse af ny laktoseformKredit:CC0 Public Domain En ny form for krystallinsk laktose er blevet opdaget ved hjælp af en del af teknikken, der giver britisk chokolade sin unikke appel. Den nye form for laktose, en ingredi -
 Spontan syntese af homogene polymernetværkFig. 1:Skematisk illustration for spontan syntese af et homogent termoresponsivt polymernetværk sammensat af polymerer med snæver molekylvægtfordeling. Kredit:Nagoya University Nagoya-forskere udv
Spontan syntese af homogene polymernetværkFig. 1:Skematisk illustration for spontan syntese af et homogent termoresponsivt polymernetværk sammensat af polymerer med snæver molekylvægtfordeling. Kredit:Nagoya University Nagoya-forskere udv
- Krystaller, der renser naturgas
- Svedesensor registrerer stressniveauer; Kan finde brug i rumforskning
- Forståelse af overfladevidenskab til fremstilling af kosmetik af høj kvalitet
- Nyt websted for European Space Agency lægger klimaet i dine hænder
- Billede:International Space Station solar transit
- Hvorfor Elon Musk tager fejl om nanoteknologi


