Ikke-steady state massehandlingsdynamik genovervejet
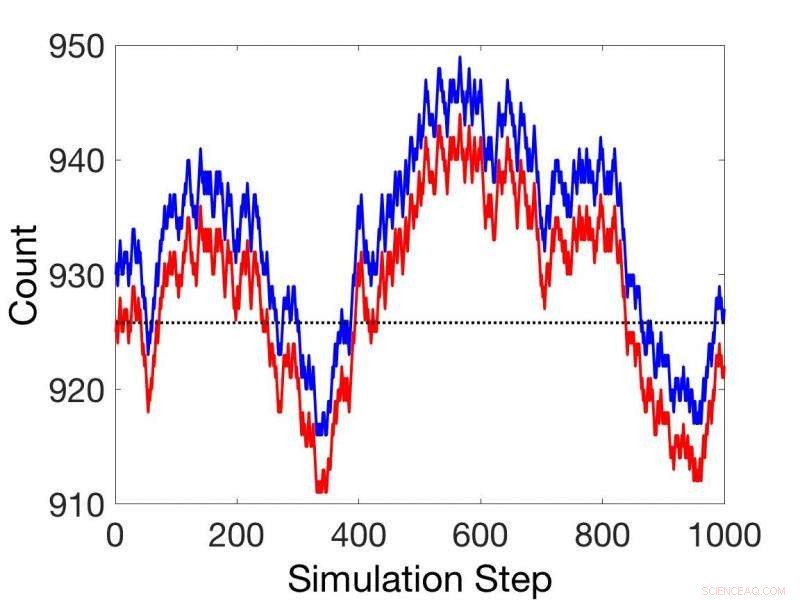
Sammenligninger mellem ikke-steady state stokastiske kinetiske simuleringer (rød) og simuleringer ved brug af koblet reaktionssætning (blå). Kredit:Pacific Northwest National Laboratory
Masseaktionsloven blev først beskrevet for 150 år siden. I dag, det er stadig et fast begreb i hver første års kemitekst. Loven siger, at hastigheden af en kemisk reaktion er proportional med koncentrationen af reaktanterne. For løsninger i dynamisk ligevægt, loven forudsiger, hvordan disse løsninger vil opføre sig.
Men det er en udfordring at anvende massehandlingens lov på komplekse systemer, såsom biologisk stofskifte. For en, de fleste hastighedskonstanter er ikke tilgængelige, og måling af de manglende er meget arbejdskrævende.
I biologisk forskning, måling af hastighedskonstanter kræver isolering og rensning af individuelle enzymer, derefter bestemme hastighedskonstanterne med spektrofotometri - dvs. hvor meget lys et kemikalie absorberer. Dette sænker gennemløbshastighederne, gør det svært at karakterisere hvert nyt genom. Trods alt, at gøre dette kræver tusindvis af hastighedsparametre.
På grund af disse problemer, et stort antal enzymhastighedsparametre er blevet bestemt for blot nogle få velbeskrevne systemer, såsom Escherichia coli. For de fleste biologiske systemer, videnskabsmænd har endnu ikke opnået hastighedskonstanter.
I mellemtiden den valgte metode til modellering af biologiske processer i stor skala (såsom metabolisme) involverer begrænsningsbaserede fluxmodeller. Men disse modeller lider af mangel på fysik vedrørende massehandlingens lov, begrænser muligheden for begrænsningsbaserede tilgange, selv når de udvides til at omfatte termodynamik og andre faktorer.
Som svar, nogle forskere har foreslået at studere elementære reaktioner ved hjælp af loven om massereaktion gennem reaktionsaffiniteter i stedet for hastighedskonstanter.
Et nyt papir i journalen Fysisk biologi af William R. Cannon og Scott E. Baker ved Pacific Northwest National Laboratory gennemgår forholdet mellem reaktionsaffinitet og fri energi for isolerede reaktioner ved at bruge begreber fra statistisk termodynamisk integration. Cannon og Baker satte sig for eksplicit at demonstrere forholdet mellem kinetiske formuleringer af hastigheder, der bruger hastighedskonstanter, og en statistisk termodynamisk formulering, der bruger kemiske potentialer.
Efterfølgende præsenterer de et teorem for koblede reaktioner baseret på kemiske potentialer, som kan give relative hastigheder for alle sekventielt koblede reaktioner under alle forhold, steady state eller ej. Dette undgår behovet for hastighedskonstanter i mange applikationer.
Brug af kemiske potentialer i stedet for hastighedskonstanter repræsenterer et metodologisk spring, som forfatterne siger, kunne signalere et stort fremskridt for prædiktiv modellering i systembiologi.
Den nye metode vil muliggøre komplekse, store biologiske systemer såsom stofskifte, der skal modelleres med kinetik og termodynamik. Dette vil resultere i mere præcise forudsigelser for design af mikroorganismer til at opføre sig på ønskede måder, som dem, der kunne udnyttes til at producere biobrændstoffer.
I øvrigt, forfatterne siger, den nye metode vil kaste grundlæggende indsigt i den termodynamiske kobling mellem levende organismer og deres miljø.
 Varme artikler
Varme artikler
-
 Faststofkatalyse:Udsving baner vejenKredit:CC0 Public Domain Brugen af effektive katalytiske midler er det, der gør mange tekniske procedurer mulige i første omgang. Ja, syntese af mere end 80 procent af de produkter, der generere
Faststofkatalyse:Udsving baner vejenKredit:CC0 Public Domain Brugen af effektive katalytiske midler er det, der gør mange tekniske procedurer mulige i første omgang. Ja, syntese af mere end 80 procent af de produkter, der generere -
 Effekten af høj temperatur på epoxyEpoxier er polymerkemikalier, der hærder i hårde overflader. Epoxy kan bruges som en del af lim eller som belægninger til overflader. Epoxy er let, korrosionshæmmende og besidder andre nyttige meka
Effekten af høj temperatur på epoxyEpoxier er polymerkemikalier, der hærder i hårde overflader. Epoxy kan bruges som en del af lim eller som belægninger til overflader. Epoxy er let, korrosionshæmmende og besidder andre nyttige meka -
 Forskere finder konformationsforstyrrelser, der indstiller ladningsbærermobilitet i 2-D perovskitte…Repræsentative transiente THz -transmissionsændringer, ΔT/T, af HA2PbI4 (n =6) for forskellige excitationsfluenser (λpump =400 nm). Symboler repræsenterer eksperimentelle data, mens faste linjer passe
Forskere finder konformationsforstyrrelser, der indstiller ladningsbærermobilitet i 2-D perovskitte…Repræsentative transiente THz -transmissionsændringer, ΔT/T, af HA2PbI4 (n =6) for forskellige excitationsfluenser (λpump =400 nm). Symboler repræsenterer eksperimentelle data, mens faste linjer passe -
 Elektronisk hud strakt til nye grænserSignaler fra den elektrisk ledende hydrogel kan tydeligt skelne mellem forskellige ansigtsudtryk. Kredit:2018 KAUST En elektrisk ledende hydrogel, der kræver strækbarhed, selvhelbredende og belast
Elektronisk hud strakt til nye grænserSignaler fra den elektrisk ledende hydrogel kan tydeligt skelne mellem forskellige ansigtsudtryk. Kredit:2018 KAUST En elektrisk ledende hydrogel, der kræver strækbarhed, selvhelbredende og belast


