Forskere udvikler bredspektrede hæmmere af influenzavirus
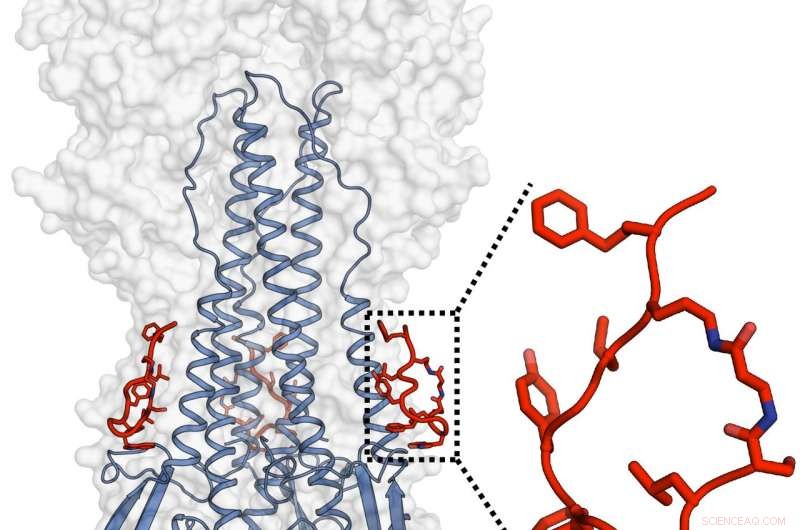
Janssen- og TSRI-holdene designede og karakteriserede et potent peptid, der efterlignede funktionaliteten af et bredt neutraliserende antistof, og som også var i stand til at målrette influenzavirushæmagglutinin. Kredit:Rameshwar U. Kadam (Ian Wilson's Lab)
Et team af forskere fra The Scripps Research Institute (TSRI) og Janssen Research &Development (Janssen) har udtænkt kunstige peptidmolekyler, der neutraliserer en bred vifte af influenzavirusstammer. Peptider er korte kæder af aminosyrer - ligesom proteiner, men med mindre, enklere strukturer. Disse designede molekyler har potentialet til at blive udviklet til medicin, der er rettet mod influenza, hvilket forårsager op til 500, 000 dødsfald på verdensplan hvert år og koster amerikanerne milliarder af dollars i sygedage og tabt produktivitet.
De udviklede peptider blokerer infektiviteten af de fleste cirkulerende stammer af gruppe 1-influenza A-virus, inklusive H5N1, en fugleinfluenza-stamme, der har forårsaget hundredvis af menneskelige infektioner og dødsfald i Asien, og H1N1-svineinfluenza-stammen, der forårsagede en global pandemi i 2009-10.
Forskerne designede peptiderne til at efterligne de virus-gribende områder af to nyligt opdagede "super-antistoffer", som er kendt for at neutralisere stort set alle influenza A-stammer. Antistoffer er store proteiner, som er dyre at producere og skal leveres ved injektion eller infusion. Hvorimod, "peptiderne udviklet i undersøgelsen har potentiale til at blive medicin leveret via pille-baserede lægemidler i fremtiden."
"At lave små molekyler, der i det væsentlige gør, hvad disse større, bredt neutraliserende antistoffer er en virkelig spændende og lovende strategi mod influenza, som vores nye resultater viser, " sagde co-senior efterforsker Ian Wilson, Hansen professor i strukturel biologi ved TSRI.
Rapporten om de nye peptider udkom som et online første udgivelsespapir i Videnskab den 28. september, 2017.
De to anti-influenza super-antistoffer, som disse peptider er baseret på, kaldet FI6v3 og CR9114, blev opdaget i 2011 og 2012. Siden da har Wilsons laboratorium på TSRI har i samarbejde med Janssen og andre strukturbiologiske laboratorier rundt om i verden kortlagt i atomskala, hvordan disse og andre bredt neutraliserende antistoffer binder til influenzavirus.
Et forskerhold ledet af David Baker ved University of Washington brugte for nylig disse antistofstrukturdata til at designe nye proteiner, mindre end antistofferne, som binder sig til influenzavirus på lignende måde og neutraliserer en bred vifte af influenza-stammer. Den nye indsats fra TSRI i samarbejde med Janssen-forskere havde til formål at udvikle endnu mindre ikke-proteinlignende molekyler, der ville ramme den samme målregion på influenzavirus.
Efter flere runder af molekylært design og syntese, virusbindingstest, og strukturel evaluering på atomniveau, forskerholdet udviklede et sæt af fire peptider med cirkulære, "cykliske" strukturer, der fungerede godt som potentielle influenzablokerende molekyler.
Peptiderne viste høj bindingsaffinitet for et bredt sæt af gruppe 1 influenza A-vira, samt en potent evne til at neutralisere infektioner med disse vira i laboratorieforsøgene. De målrettede gruppe 1-influenza A-vira omfatter H1, H2, H5 og H6 undertyper.
Peptiderne inkorporerede også aminosyrebyggesten, som ikke findes i naturlige proteiner, og dette, såvel som deres cykliske strukturer, gjort dem relativt resistente over for de enzymer, der ellers hurtigt kan fjerne peptidlægemidler fra blodbanen. Den mest optimerede af de fire peptider, kaldet P7, overlevede i timevis, når de blev udsat for mus eller humant blodplasma, eller når de injiceres i mus.
"Disse peptider har lægemiddellignende stabilitet og vil være gode kandidater til yderligere test af antiviral effekt i dyremodeller, " sagde Rameshwar U. Kadam, en senior postdoktoral forskningsmedarbejder i Wilson Laboratory, som er medførsteforfatter af undersøgelsen sammen med Jarek Juraszek, Principal Scientist hos Janssen.
Peptiderne, ligesom de antistoffer, de er designet til at efterligne, bindes til et sted kendt som den hydrofobe stammerille på den nederste del af influenzavirusets hovedkappeprotein hæmagglutinin. Den molekylære struktur på dette sted har ikke tendens til at variere meget blandt influenzastammer, fordi den spiller en afgørende rolle i en formskiftende proces, der tillader virussen at trænge ind i værtscellen og initiere infektion. Strukturelle evalueringer af Kadam fandt ud af, at peptiderne forhindrer denne formændring og dermed forhindrer værtscellepenetration.
"En terapi, der er rettet mod det første infektionsstadium, vil komplementere de eksisterende anti-influenzalægemidler, der retter sig mod senere infektionsstadier, " sagde Kadam.
Peptiderne binder sig ikke så omfattende til deres virale mål som de antistoffer, de er baseret på. På gruppe 2 influenza A vira, for eksempel, de manglede de større antistoffers evne til at skubbe til side eller undgå et sukkermolekyle på hæmagglutinin, der blokerer en vigtig del af målstedet. Imidlertid, Kadam sagde, at yderligere undersøgelser kan give peptider med aktivitet mod både gruppe 1 og gruppe 2 influenza A og endda influenza B stammer.
"Det er ret revolutionerende, at vi var i stand til at bruge strukturel information om antistoffer til at lave meget mindre molekyler, der har næsten samme bindingsaffinitet og bredde af neutralisering mod influenzavirus, " sagde Kadam.
"Der har været skepsis på området, at vi kunne få så gode resultater med så små molekyler, men denne undersøgelse viser, at vi kan, " sagde Wilson.
Sidste artikelGennembrud hurtigt, massescreening for ebola-virus
Næste artikelElektrisk opvarmede tekstiler nu muligt
 Varme artikler
Varme artikler
-
 Hvordan reducerer man drivhusgasser? Tips fra en metanædende mikrobeMetan-spisende bakterier findes i ekstreme miljøer såsom aktive geotermiske varme kilder. Kredit:Inger Eriksen/Shutterstock Forskere har bestemt strukturen af et unikt enzym, produceret af en ar
Hvordan reducerer man drivhusgasser? Tips fra en metanædende mikrobeMetan-spisende bakterier findes i ekstreme miljøer såsom aktive geotermiske varme kilder. Kredit:Inger Eriksen/Shutterstock Forskere har bestemt strukturen af et unikt enzym, produceret af en ar -
 Glødende bakterier opdager begravede landminerFjerndetektering af nedgravede landminer er en mulig anvendelse af system til fjerndetektering af nedgravede landminer ved hjælp af en bakteriel sensor og et laserbaseret scanningssystem. Kredit:hebra
Glødende bakterier opdager begravede landminerFjerndetektering af nedgravede landminer er en mulig anvendelse af system til fjerndetektering af nedgravede landminer ved hjælp af en bakteriel sensor og et laserbaseret scanningssystem. Kredit:hebra -
 Ny måde at opdage ekstase påKredit:Syddansk Universitet Mens man bygger molekylære maskiner, forskere faldt over en ny metode til at opdage ekstase. Opdagelsen kan føre til mere pålidelige lægemiddeltest. Forskere ved Sydda
Ny måde at opdage ekstase påKredit:Syddansk Universitet Mens man bygger molekylære maskiner, forskere faldt over en ny metode til at opdage ekstase. Opdagelsen kan føre til mere pålidelige lægemiddeltest. Forskere ved Sydda -
 Selvhelbredende materiale et gennembrud for bio-inspireret robotteknologiEt digitalt ur fortsætter med at holde tiden, da beskadigede kredsløb øjeblikkeligt heler sig selv, omdirigering af elektriske signaler uden afbrydelse. Kredit: Naturmaterialer Mange naturlige or
Selvhelbredende materiale et gennembrud for bio-inspireret robotteknologiEt digitalt ur fortsætter med at holde tiden, da beskadigede kredsløb øjeblikkeligt heler sig selv, omdirigering af elektriske signaler uden afbrydelse. Kredit: Naturmaterialer Mange naturlige or
- Giver følelse af tumult under havet for at lokalisere rystelser nær dybe havfejl
- En potentiel ny solcreme er koralsikker og giver mere UVB/UVA-beskyttelse
- Hvem træffer bedre beslutninger:mennesker eller robotter?
- Hvad hvis vi borede ned i en supervulkan?
- NASAs Voyager 2-sonde går ind i det interstellare rum
- Ny nanoskala billeddannelsesmetode finder anvendelse i plasmonics


