En hvis ved at redigere, to ved vejspærring:Humant protein bekæmper HIV som monomer og dimer
Forskning for nylig offentliggjort i Naturkommunikation undersøger mulighederne for et humant protein, der hæmmer HIV-1, APOBEC3G (A3G). Papiret fremhæver arbejdet af Northeastern Physics professor og formand Mark Williams, postdoc forsker Mike Morse, Professor Linda Chelico, University of Saskatchewan i Canada, og Ioulia Rouzina, Ohio State University. Kredit:Mike Morse/Northeastern University
For femten år siden, en klasse af proteiner blev opdaget, som giver mennesker medfødt immunitet mod HIV-1. Desværre, HIV-1 er en smart virus og har udviklet sig til at bekæmpe disse proteiner. Nordøstlige forskere, med hjælp fra deres samarbejdspartnere, har studeret disse proteiner i flere år for at hjælpe yderligere med at forstå deres funktion og mekanismer i håbet om at blive bedre forberedt mod HIV-1.
Forskningen, udgivet i Naturkommunikation , fremhæver arbejdet af Northeastern Physics professor og formand Mark Williams, postdoc forsker Mike Morse, Professor Linda Chelico, University of Saskatchewan i Canada, og Ioulia Rouzina, Ohio State University. Artiklen undersøger mulighederne for et humant protein, der hæmmer HIV-1, APOBEC3G (A3G).
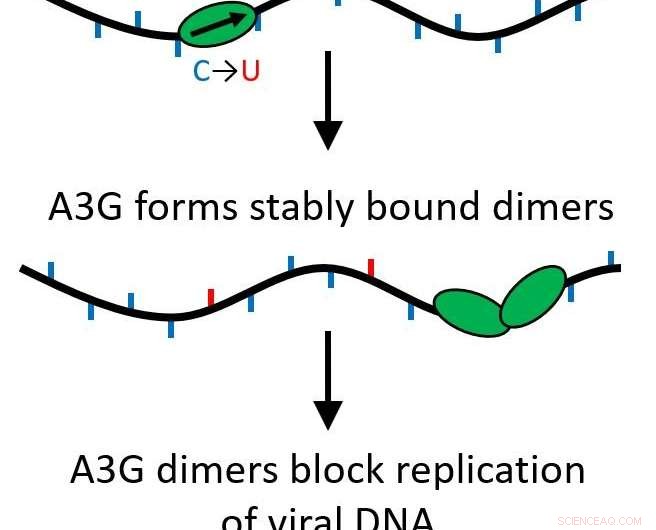
Deres resultater fastslog, at når A3G-proteinet vokser fra et enkelt protein (monomer) til et to-proteinkompleks (dimer), dets funktion er transformeret fra at være et editerende protein, der muterer viralt DNA til at fungere som en vejspærring for yderligere replikation af virussen.
"Jeg var fuldstændig overrasket over resultatet, at dimerer var tilstrækkelige til at gøre dette, " sagde Williams. "Vi har vores data, og dataene fortalte os dette, men det tog os lang tid at indse, at den eneste måde at forstå disse data på er, at dimerer skal være modellen for, at proteinets egenskaber pludselig ændrer sig."
Williams Laboratory for Single Molecule Biophysics har specialiseret sig i instrumenter kaldet optiske pincet, der studerer molekyler såsom enkelte DNA-molekyler eller DNA-proteinkomplekser. Dette værktøj holder DNA eller RNA mellem to polystyrenperler for at se på interaktioner med DNA'et ved at observere ændringer i dets længde og spænding. Ved at bruge denne teknik, laboratoriet studerer mange forskellige biologiske systemer, herunder HIV-1-replikation. En kombination af disse biofysiske metoder med enzymaktivitetseksperimenter og skabelsen af mutantformer af A3G af Chelico-laboratoriet gjorde det muligt for Williams og Morse at sammenligne den oprindelige form af proteinet med forskellige mutanter, der indeholdt strukturelle ændringer. Dette muliggjorde isolering af processen, der resulterede i stabilt bundet dimeriseret protein.
I de sidste 12 år, Williams-laboratoriet har studeret HIV-1-replikation med hjælp fra en NIH-bevilling. Deres seneste projekt involverer at forstå de medfødte immunproteiner, der giver mennesker immunitet mod HIV-1. Der er syv proteiner i APOBEC3-familien, hvoraf nogle bekæmper retrovira som HIV-1, mens andre kæmper mod retrotransposoner, som er genetiske elementer, der forstærker sig selv i et genom og har potentiale til at forårsage sygdom.
Alle APOBEC-proteiner er cytidindeaminaser, giver dem mulighed for at modificere enkeltstrenget DNA for at erstatte baser, forårsager mutationer, når strengen replikeres. Imidlertid, A3G har også en anden funktion, der gør det modsatte. I stedet for hurtigt at glide langs genomet og foretage redigeringer, det kan blive et stabilt bindende protein, der hæmmer den omvendte transkriptionsprocessen i at forekomme, forhindre HIV-1 replikation. Dette sker på grund af en proces kaldet oligomerisering, hvor enkelte proteinenheder (monomerer) går sammen for at skabe multiproteinkomplekser eller oligomerer.
"Ideen om, at du kunne zoome sammen og lave disse ændringer, og alligevel blokerer noget andet i at bevæge sig, gav ikke rigtig mening, " sagde Williams. "Det er derfor, oligomeriseringen er så vigtig. Mens de starter hurtigt og bevæger sig, over tid oligomeriseres de og bliver meget langsomme."
Dette team af forskere opdagede oligomeriseringen som offentliggjort i deres 2014-artikel i Naturkemi . Deres undersøgelse viste, at væksten af et multiproteinkompleks fik proteinet til at bremse, men det var ikke kendt, hvor mange proteiner der skulle til for at lave et langsomt kompleks. Hvis tallet var højt, resultaterne er muligvis ikke relevante for viral replikation. Ud over, de kunne vise, at komplekserne var langsomme, men de kunne ikke se, om de langsomme komplekser havde enzymaktivitet. Men nu har deres nye forskning fundet svarene på disse to kritiske spørgsmål.
"Mellem vores eksperimenter, hvor vi direkte observerede bindingen af proteiner til DNA, og professor Chelicos arbejde med at undersøge den enzymatiske aktivitet af A3G, vi fandt, at på korte tidsskalaer i den monomere form, proteinet binder og dissocierer meget hurtigt fra DNA og har høj enzymatisk aktivitet, " sagde Morse. "Men når du lader det danne disse oligomerer, bindingen er meget mere stabil, og dissocierer ikke så let. Professor Chelico var i stand til at finde ud af, at den enzymatiske aktivitet faktisk falder, når denne proces finder sted, så du har disse to funktioner - den enzymatiske aktivitet, der forekommer på engangsskala, og i én form, og denne sekundære funktion, på grund af oligomeriseringen, sker på en anden tidsskala."
Deres forskning viste, at dette sker, selvom kun to proteiner kommer sammen, danner en dimer. Dimeren er nok til at gøre proteinkomplekset stabilt og ændre proteinets funktion. Da kun en dimer er nødvendig, flere vejspærringer kan virke for at forhindre omvendt transskription i at forekomme. Nu, denne vigtige funktion er mere tilbøjelig til at være biologisk relevant.
"At vide, hvordan noget hæmmer HIV-1, kunne være en guide til at hjælpe med at designe nye metoder til anti-HIV-lægemidler. HIV-1-virussen har udviklet sit eget protein til at narre cellen til at nedbryde APOBEC-proteiner, så hvis vi kan finde ud af, hvordan vi kan stoppe den nedbrydning, måske ville vi være i stand til at forbedre dette proteins evne til at hæmme HIV-1, " sagde Williams.
Williams Lab ved Northeastern University planlægger at fortsætte med at studere de forskellige APOBEC-proteiner, hvoraf andre hæmmer HIV-1 eller retrotransposoner. Gennem at studere disse proteiner med deres unikke biofysiske måleværktøjer, deres laboratorium håber at forstå proteinernes regulering, aktivitet, og processer, der hjælper os med at være yderligere forberedte mod HIV og andre relaterede sygdomme.
 Varme artikler
Varme artikler
-
 Bare et lille stykke papir kan gøre vandforbruget mere sikkertKredit:University of Bath En revolutionær mikrobiel-baseret papirsensor er blevet udviklet af forskere ved University of Bath, skabe en billig, bæredygtig og genanvendelig enhed til påvisning af g
Bare et lille stykke papir kan gøre vandforbruget mere sikkertKredit:University of Bath En revolutionær mikrobiel-baseret papirsensor er blevet udviklet af forskere ved University of Bath, skabe en billig, bæredygtig og genanvendelig enhed til påvisning af g -
 Kemiske projekter med citronNår du tænker på citroner, tænker du på surt. Det er fordi citronsaft er meget surt. Den har en pH på omkring 2 på en skala, der måler surhedsgrad eller alkalitet fra 0 til 14. 100 gram citronsaft - s
Kemiske projekter med citronNår du tænker på citroner, tænker du på surt. Det er fordi citronsaft er meget surt. Den har en pH på omkring 2 på en skala, der måler surhedsgrad eller alkalitet fra 0 til 14. 100 gram citronsaft - s -
 Oligourea foldamerer efterligner peptider alfa-helices og binder effektivt til lægemiddelmålKredit:Wiley Nogle nyttige lægemidler består af peptider, der virker på deres proteinmål. For at gøre dem mere effektive og stabile, forskere har fundet en måde at erstatte afgørende segmenter af
Oligourea foldamerer efterligner peptider alfa-helices og binder effektivt til lægemiddelmålKredit:Wiley Nogle nyttige lægemidler består af peptider, der virker på deres proteinmål. For at gøre dem mere effektive og stabile, forskere har fundet en måde at erstatte afgørende segmenter af -
 Blanding af kunstige sødestoffer hæmmer bitter smagsreceptorerKredit:CC0 Public Domain Blandinger af kunstige sødestoffer som saccharin og cyclamat giver mindre bitter bismag end hver af de individuelle komponenter, men forklaringen på dette forvirrende fæno
Blanding af kunstige sødestoffer hæmmer bitter smagsreceptorerKredit:CC0 Public Domain Blandinger af kunstige sødestoffer som saccharin og cyclamat giver mindre bitter bismag end hver af de individuelle komponenter, men forklaringen på dette forvirrende fæno
- 30, 000 år gamle tvillingerester fundet i gammel grav i Østrig
- Ny, glat toiletbelægning giver renere skylning, sparer vand
- Google Maps fylder 15 år:Her er 15 tips til at få mest muligt ud af appen
- Forskerhold udvikler rekordlaser på chip
- Starbucks forpligter 10 millioner dollars til en grønnere kaffekop
- Byer har brug for mere end aircondition for at komme igennem hedebølger


