Fluorescerende sonder for at studere cellulær aktivitet
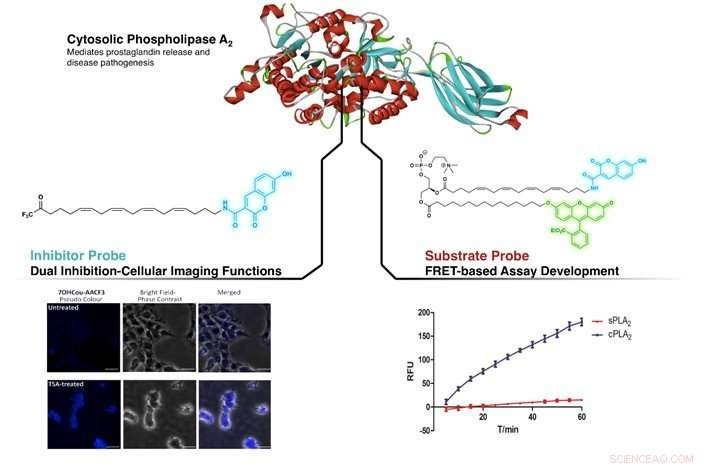
Figur viser målretning af cPLA2 af den nydesignede inhibitor og substratsonde. Til venstre:Identificering af forskelle i cPLA2 -niveau i ubehandlet og Trichostatin A (TSA, en inhibitorforbindelse) -behandlede SHSY5Y-celler. Til højre:Påviser højere selektivitet for cPLA2 mod sPLA2 (et andet medlem af phospholipase A2-familien) ved FRET-baseret analyse ved hjælp af substratproben. Kredit:NG Cheng Yang, CAO Xujun
NUS -kemikere har for nylig udviklet selektive prober til cytosolisk phospholipase A2 (cPLA2) for at bestemme enzymniveauer og aktivitet.
cPLA2 er et vigtigt enzym stærkt anvendt til at regulere inflammatoriske reaktioner i kroppen. Det har vundet stor interesse medicinsk, med stigende forbindelser til dets involvering i inflammatoriske og neurologiske sygdomme såsom Alzheimers sygdom og multipel sklerose. Evnen til at billede og korrekt identificere cPLA2 i biologiske systemer er vigtig for at forstå de mekanistiske veje, der er involveret i disse sygdomme. Et team ledet af prof. LAM Yulin fra Institut for Kemi, NUS har opdaget nogle fluorescerende forbindelser, der kan forestille cPLA2. Disse inkluderer en inhibitor (forbindelse, der reducerer enzymaktiviteten) og et substrat (forbindelse, som enzymet virker på), der udviser fluorescens.
Ved at efterligne strukturen af en velkendt hæmmer af cPLA2, arachidonyltrifluormethylketon (AACOCF3), forskergruppen har med succes vedhæftet et fluorescerende organisk farvestof (coumarin) på kulstofkædeenden af AACOCF3. Dette skabte en fluorogen form for AACOCF3, som bevarede sin native hæmmende aktivitet mod cPLA2. Foreløbige undersøgelser udført på den nydesignede forbindelse viste dets evne til at differentiere mellem celler indeholdende forskellige niveauer af cPLA2. Samtidig, denne nyudviklede probe var i stand til at hæmme cPLA2, giver en dobbelt rolle af billeddannelse og hæmning. Dette giver biokemikere mulighed for direkte at detektere enzymet på celleniveau, samtidig med at det bevirker en tilsigtet biologisk reaktion.
Opmuntret af disse resultater, forskergruppen udvidede deres studier ved at udvikle en anden sonde til måling af cPLA2 -aktivitet. Den konventionelle analyse af cPLA2 -aktivitet anvender en radioaktiv forbindelse som et substrat. Imidlertid, brugen af sådanne assays er meget uønsket på grund af farerne omkring radioaktive materialer. For at omgå dette problem, forskellige kalorimetriske og fluorogene assay -kits til måling af cPLA2 -aktivitet er nu kommercielt tilgængelige. Imidlertid, disse assays kan også påvise andre enzymer i PLA2 -familien og er ikke kun selektive for cPLA2. Det ville være nyttigt at have en alternativ sonde, som specifikt er målrettet mod cPLA2.
Ved at anvende en lignende tilgang, fluorogene coumarin- og fluorescein -dele (et andet fluorescerende organisk farvestof) blev fæstnet til phosphatidylcholin (et substrat for cPLA2). Dette forårsager en ikke-strålende intern overførsel af energi mellem det ene farvestof til det andet, når den lysfølsomme del bestråles ved sin excitationsbølgelængde; et fænomen kendt som Förster resonance energy transfer (FRET). Denne nye substratsonde viste sig at være yderst selektiv til cPLA2, uden tab af native aktivitet og egnet til inhibitor -screeningsassays.
Gruppen undersøger i øjeblikket virkningerne af vedhæftning af fluorescerende kemiske forbindelser med forskellige farver på både inhibitor- og substratprober for at udvide deres applikationer.
 Varme artikler
Varme artikler
-
 Easy Home-eksperimenter ved hjælp af gasloveGaslovene er lette at demonstrere med husholdningsartikler til hverdagen. Disse relaterede videnskabelige principper beskriver, hvordan volumen, tryk og temperatur for en gas ændrer sig under forskell
Easy Home-eksperimenter ved hjælp af gasloveGaslovene er lette at demonstrere med husholdningsartikler til hverdagen. Disse relaterede videnskabelige principper beskriver, hvordan volumen, tryk og temperatur for en gas ændrer sig under forskell -
 Korrosionsbestandighed i rustfrit stål til svovlsyreMed kun få undtagelser - guld, palladium og platin - korroserer alle metaller. Dette omfatter rustfrit stål. En almindelig misforståelse er, at rustfrit stål er 100 procent korrosionsbestandigt som fo
Korrosionsbestandighed i rustfrit stål til svovlsyreMed kun få undtagelser - guld, palladium og platin - korroserer alle metaller. Dette omfatter rustfrit stål. En almindelig misforståelse er, at rustfrit stål er 100 procent korrosionsbestandigt som fo -
 Bakterielle biofilm, forsvindEn kunstners repræsentation af bakterier (lilla) bliver kompromitteret af en organisk rammefilm i kitosan-metal. Kredit:Colorado State University/ Avancerede funktionelle materialer Efter nogle
Bakterielle biofilm, forsvindEn kunstners repræsentation af bakterier (lilla) bliver kompromitteret af en organisk rammefilm i kitosan-metal. Kredit:Colorado State University/ Avancerede funktionelle materialer Efter nogle -
 Ny tilgang til blødt materialestrøm kan give vej til nye materialer, katastrofeforudsigelseEn ny undersøgelse fra ingeniører ved University of Illinois, Urbana-Champaign bruger enkle eksperimenter til at forklare, hvordan en bedre forståelse af flydende bevægelse af bløde materialer vil hjæ
Ny tilgang til blødt materialestrøm kan give vej til nye materialer, katastrofeforudsigelseEn ny undersøgelse fra ingeniører ved University of Illinois, Urbana-Champaign bruger enkle eksperimenter til at forklare, hvordan en bedre forståelse af flydende bevægelse af bløde materialer vil hjæ
- Grafenplasmoner når det infrarøde
- Team udvikler en familie af bioinspirerede kunstige træsorter fra traditionelle harpikser
- To amerikanske rumvandrere erstatter låsende ende af robotarm
- Smarte polymerer omdanner elektrisk energi til mekanisk arbejde
- Atomisk vej fra isolator til metal mere rodet end troet
- Et farvel til Plutoshine


