Neutroner undersøger iltgenererende enzym for en grønnere tilgang til rent vand
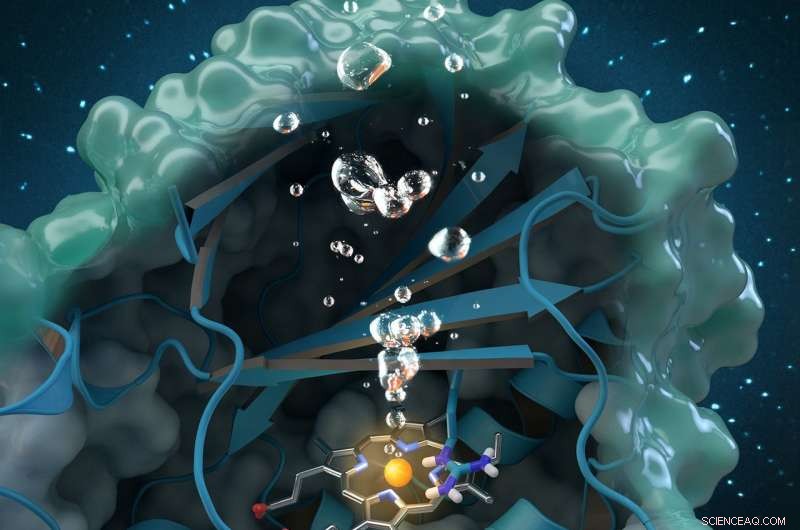
Kloritdismutase er et unikt oxygendannende enzym, der nedbryder chlorit, et industrielt forurenende stof, der findes globalt i grundvandet, drikkevand og jord. Forskning udført på ORNL bidrager til en omfattende strukturel og biokemisk analyse af enzymet, bane vejen for fremtidige miljøanvendelser. Kreditering:Tidsskriftets omslag genoptrykt med tilladelse fra ACS katalyse , vol. 7, udgave 11, 3. november, 2017.
En ny undersøgelse kaster lys over et unikt enzym, der kan give en miljøvenlig behandling af chlorit-forurenede vandforsyninger og forbedre vandkvaliteten på verdensplan.
Et internationalt team af forskere ledet af Christian Obinger fra universitetet i Wien brugte neutronanalyse på Oak Ridge National Laboratory, røntgenkrystallografi og andre teknikker til undersøgelse af chloritdismutaseenzymet. Dette naturligt forekommende protein kan nedbryde chlorit, et industrielt forurenende stof fundet i grundvandet, drikkevand og jord, til harmløse biprodukter, men dens katalytiske proces er ikke godt forstået. At forstå, hvordan det bakterielle enzym omdanner chlorit til klorid og oxygen, kan åbne muligheder for fremtidige anvendelser inden for bioremediering og bioteknologi.
Resultaterne, udgivet i ACS katalyse , også bidrage til grundlæggende forskning i enzymets evne til at producere ilt. Oxygengenerering er utrolig sjælden i naturen, engang troede man kun muligt ved fotosyntese, så den enzymatiske aktivitet af chloritdismutase har tiltrukket sig interesse fra det videnskabelige samfund ud over dets miljømæssige anvendelser for rent vand.
Præcis hvordan chloritdismutase virker på molekylært niveau for at nedbryde klorit, har været diskuteret siden enzymet blev opdaget i 1996. Kompleksiteten af enzymets molekylstruktur og vanskeligheden ved at studere proteiner med eksperimentelle metoder udgør iboende udfordringer for forskere.
Som de fleste enzymer, chloritdismutase er et protein, der katalyserer en meget specifik reaktion. Processen er ofte miljøafhængig, hvilket betyder, at det fungerer bedst inden for bestemte parametre, inklusive temperatur, koncentration og pH-områder. At identificere de ideelle parametre for reaktionen er nøglen til at understøtte bioteknologi og storskalaproduktion af chloritdismutase for sikkert at fjerne chlorit fra miljøet og potentielt udnytte enzymets iltgenerering.
Holdet isolerede en uundersøgt Cyanothece-stamme af chloritdismutase og undersøgte proteinets krystalstruktur ved specifikke pH-værdier for at bestemme virkningen af pH på chloritomdannelse.
Forskerne brugte MaNDi, det makromolekylære neutrondiffraktometer, strålelinje 11-B ved spallationsneutronkilden, en Department of Energy User Facility på ORNL, at indsamle unikke data, der kun kan opnås ved brug af neutroner.
"Forskellige proteinkrystaller har forskellige grader af symmetri, som vil afgøre, hvordan vi går om at måle dem. Denne krystal er usædvanlig, fordi den har meget lidt symmetri, så et særligt stort antal refleksioner skal optages individuelt for at få et komplet datasæt, "sagde Leighton Coates, ManDi Lead Instrument Scientist. "Dette ville være en udfordrende og langvarig opgave hvor som helst, og det var kun opnåeligt i denne tidsramme på grund af det store områdedetektordækning af MaNDi-instrumentet."
På ManDi, forskere var i stand til at påvise protonationstilstande af vigtige aminosyrer, der menes at understøtte reaktionen. "Protonering" refererer til et fundamentalt trin i katalyse, hvor hydrogen binder sig til molekyler. "Dette er den vigtige region af proteinet, hvor kemien foregår og chloritten bliver nedbrudt, "sagde Coates.
Protonationstilstande er ikke let at observere, fordi de involverer brint, som er svær at opdage med røntgen eller andre teknikker. Ud over, et fænomen kaldet "fotoreduktion" opstår, når metalholdige enzymer som chloritdismutase udsættes for røntgenstråler, væsentligt ændrer prøvens atomare struktur.
Fordi neutronteknikker ikke har disse begrænsninger, de kan give forskere nøgleinformation, som ikke kan opnås ved andre metoder. "Neutroner er ikke-destruktive og følsomme over for lette elementer som brint, så de kan give eksklusiv information om atomstrukturen af proteiner, som stort set består af brintmolekyler, " Forklarede Coates.
"Og i modsætning til røntgenstråler, der kan beskadige sarte proteiner, neutronteknikker giver dig mulighed for at indsamle data ved stuetemperatur på et uændret protein i dets aktive tilstand uden virkningerne af ioniserende stråling og fotoreduktion, " sagde Coates. "Dette eksperiment fremhæver virkelig fordelen ved at bruge neutroner til at studere proteiner."
 Varme artikler
Varme artikler
-
 Ny mekanisme til at ødelægge vira kan føre til fremtidige behandlingerDer vises et overfladebillede af en almindelig forkølelsesvirus, når den er kompleks med det antigenbindende fragment af et neutraliserende antistof. Farverne svarer til overfladens afstand fra virusc
Ny mekanisme til at ødelægge vira kan føre til fremtidige behandlingerDer vises et overfladebillede af en almindelig forkølelsesvirus, når den er kompleks med det antigenbindende fragment af et neutraliserende antistof. Farverne svarer til overfladens afstand fra virusc -
 Et periodisk system med molekylære knuderHvilke nye knudetyper vil det være muligt at realisere i fremtiden? Dette er det udfordrende spørgsmål, som SISSA -forskere, i samarbejde med University of Padua, har tacklet ved hjælp af computersimu
Et periodisk system med molekylære knuderHvilke nye knudetyper vil det være muligt at realisere i fremtiden? Dette er det udfordrende spørgsmål, som SISSA -forskere, i samarbejde med University of Padua, har tacklet ved hjælp af computersimu -
 Videnskabsprojekter: Sådan undgås is fra smeltningDet er ikke umuligt at forhindre, at is smelter for evigt uden at lægge den i en fryser, men du kan bruge et par enkle metoder til at holde den kold i længere tid og forsinke smeltningen. Is er som
Videnskabsprojekter: Sådan undgås is fra smeltningDet er ikke umuligt at forhindre, at is smelter for evigt uden at lægge den i en fryser, men du kan bruge et par enkle metoder til at holde den kold i længere tid og forsinke smeltningen. Is er som -
 Faktorer, der påvirker varmeledningsevnenTermisk ledningsevne, også kaldet varmeledning, er strømmen af energi fra noget med en højere temperatur til noget med en lavere temperatur. Det adskiller sig fra elektrisk ledningsevne, der omhandl
Faktorer, der påvirker varmeledningsevnenTermisk ledningsevne, også kaldet varmeledning, er strømmen af energi fra noget med en højere temperatur til noget med en lavere temperatur. Det adskiller sig fra elektrisk ledningsevne, der omhandl
- Åbn den sorte boks med automatiseret maskinlæring
- Hvordan man får rødfosfor
- IAG køber Air Europa midt i luftfartssektorens omvæltning
- Ukendt sprog opdaget i Sydøstasien
- Nanoreaktorstrategi genererer overlegne understøttede bimetalliske katalysatorer
- Ingeniører udvikler en ny strategi til at designe bittesmå halvlederpartikler til vidtgående appl…


