Cryo-EM afslører kronelignende struktur af protein, der er ansvarlig for at regulere blodgennemstrømningen
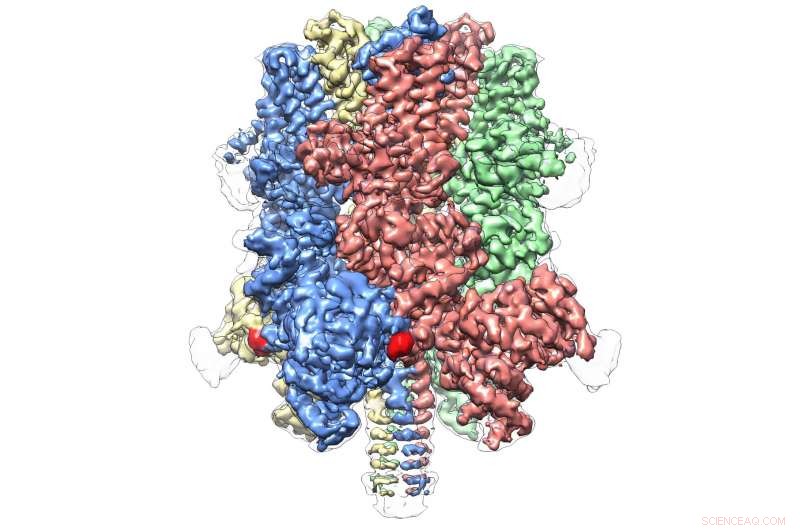
Human TRPM4 bundet med agonisten Ca+ og modulator DVT ved 3,8 Å. Kredit:Wei Lü, Ph.D.
Et hold ledet af forskere ved Van Andel Research Institute (VARI) har for første gang afsløret strukturen på atomniveau af et lovende lægemiddelmål for tilstande som slagtilfælde og traumatisk hjerneskade.
Kaldet TRPM4, dette protein findes i væv i hele kroppen, inklusive hjernen, hjerte, nyre, tyktarm og tarme, hvor det spiller en stor rolle i at regulere blodgennemstrømningen via blodkarsammensnævring samt indstille hjertets rytme og moderere immunreaktioner.
"Det er afgørende at forstå den rolle TRPM4 spiller i reguleringen af cirkulationen, men i årevis har forskning været begrænset af manglende indsigt i dens molekylære arkitektur, " sagde Wei Lü, Ph.D., en adjunkt ved VARI og hovedforfatter på en undersøgelse, der beskriver TRPM4's struktur, offentliggjort i dag i Natur . "Vores resultater giver ikke kun en detaljeret, kort på atomniveau over dette kritiske protein, men afslører også helt uventede facetter af dens makeup."
TRPM4 er kritisk involveret i at regulere blodforsyningen til hjernen, som kun udgør omkring 2 procent af kroppens samlede vægt og alligevel modtager 15 til 20 procent af sin blodforsyning. Tilstande, der forstyrrer blodgennemstrømningen i hjernen, såsom slagtilfælde, traumatisk hjerneskade, cerebralt ødem og hypertension, kan have ødelæggende konsekvenser og er betydelige folkesundhedsproblemer.
"Der findes mange sikkerhedsforanstaltninger i hjernens kredsløb for at beskytte mod en pludselig afbrydelse i blodforsyningen, hvoraf den ene er TRPM4, "Lü sagde. "Vi håber, at en bedre forståelse af, hvordan dette protein ser ud, vil give forskerne et molekylært plan, som de kan basere designet på mere effektiv medicin med færre bivirkninger på."
Strukturen af TRPM4 er markant forskellig fra de andre molekyler i TRP-superfamilien, en kategori af proteiner, der medierer reaktioner på fornemmelser og sensoriske stimuli, såsom smerter, tryk, vision, temperatur og smag. Bredt kendt som ionkanaler, proteiner som TRP putter sig inde i cellernes membraner, fungerer som gatekeepere for kemiske signaler, der passerer ind og ud af cellen.
Selv inden for sin egen underfamilie, som omfatter otte molekyler i alt, TRPM4 ser ud til at være helt unik. Dagens udgivelse repræsenterer det første atomsyn fra et medlem af TRPM-underfamilien.
Den afslører en kronelignende struktur, med de fire toppe, der udgør et stort N-terminalt domæne - et kendetegn for TRPM-proteiner. denne region, fundet i starten af molekylet, er et vigtigt sted for interaktion med det cellulære miljø og andre molekyler i kroppen. I den modsatte ende af TRPM4, almindeligvis kaldet C-terminal domæne, Lüs team fandt en paraplylignende struktur understøttet af en "stang" og fire spiralformede "ribber" - egenskaber, der aldrig før er blevet observeret.
Resultaterne blev muliggjort af VARI's avancerede David Van Andel Advanced Cryo-Electron Microscopy Suite, som gør det muligt for videnskabsmænd at se nogle af livets mindste komponenter i udsøgte detaljer. VARIs største mikroskop, Titan Krios, er en af færre end 120 i verden og er så kraftig, at den kan visualisere molekyler 1/10, 000. bredden af et menneskehår.
Lüs struktur er den anden molekylære struktur, der er bestemt på Instituttets Krios siden færdiggørelsen af suitens installation tidligere i år.
 Varme artikler
Varme artikler
-
 Belyser usynlige blodige fingeraftryk med en fluorescerende polymerFingeraftryksmønstre fremstillet i blod er tydeligt synlige på aluminiumsfolie (venstre) og malet træ (højre), når de udvikles med en fluorescerende polymer. Kredit:Tilpasset fra ACS Applied Materials
Belyser usynlige blodige fingeraftryk med en fluorescerende polymerFingeraftryksmønstre fremstillet i blod er tydeligt synlige på aluminiumsfolie (venstre) og malet træ (højre), når de udvikles med en fluorescerende polymer. Kredit:Tilpasset fra ACS Applied Materials -
 Væske har struktur, hvilket kan være nøglen til at forstå metallisk glasBillede fra transmissionselektronmikroskop af metalliske glas nanorods. Kredit:Judy Cha Forskere har fundet ud af, at væske har struktur under visse omstændigheder, og at denne struktur i væsentli
Væske har struktur, hvilket kan være nøglen til at forstå metallisk glasBillede fra transmissionselektronmikroskop af metalliske glas nanorods. Kredit:Judy Cha Forskere har fundet ud af, at væske har struktur under visse omstændigheder, og at denne struktur i væsentli -
 Afslører svindel med kød og fisk med en håndholdt MasSpec Pen på få sekunderMasSpec Pen kan autentificere typen og renheden af kødprøver på så lidt som 15 sekunder. Kredit: Tidsskrift for landbrugs- og fødevarekemi Svindel med kød og fisk er globale problemer, koster f
Afslører svindel med kød og fisk med en håndholdt MasSpec Pen på få sekunderMasSpec Pen kan autentificere typen og renheden af kødprøver på så lidt som 15 sekunder. Kredit: Tidsskrift for landbrugs- og fødevarekemi Svindel med kød og fisk er globale problemer, koster f -
 Stabil, selvforstyrrende mikrobobler som intravenøse iltbærereKredit:Wiley Alvorlig iltmangel fører til sidst til hjertestop. Hvis blodets iltindhold ikke hurtigt kan genetableres, patienten kan dø inden for få minutter. I journalen Angewandte Chemie , Ame
Stabil, selvforstyrrende mikrobobler som intravenøse iltbærereKredit:Wiley Alvorlig iltmangel fører til sidst til hjertestop. Hvis blodets iltindhold ikke hurtigt kan genetableres, patienten kan dø inden for få minutter. I journalen Angewandte Chemie , Ame
- CALET foretager første direkte målinger af elektroner med høj energi i rummet
- Chip Wars:Teknisk rivalisering ligger til grund for handelskonflikt mellem USA og Kina
- Kønsantagelser skader fremskridt med hensyn til klimatilpasning og modstandsdygtighed
- Forskere demonstrerer alsidighed af solid-state protein sensor
- Ingen planeter nødvendige:NASA-undersøgelse viser, at diskmønstre kan generere sig selv
- Stingrayets økosystem


